日前,FDA官网显示的药物审批信息显示,由Biogen和Alkermes联合研发的复发性多发性硬化症(MS)新疗法Vumerity(富马酸地肟酯)获得FDA临时批准。Vumerity是一种具有独特分子结构的口服富马酸盐。与已被批准用于治疗MS的替非替拉(富马酸二甲酯)相比,具有更好的胃肠道安全性和耐受性。

多发性硬化(MS)是一种自身免疫性疾病。患者的免疫系统攻击保护神经的髓鞘,导致神经无法正常传导电信号,影响大脑与身体其他部位的交流。最终,神经本身会退化。复发性多发性硬化是多发性硬化最常见的类型,其特征是疾病的周期性复发和缓解。
富马酸地肟酯是口服富马酸酯的前体。在体内可迅速转化为富马酸单甲酯。富马酸单甲酯可以通过激活名为Nrf2的转录因子来减少氧化应激造成的损伤。
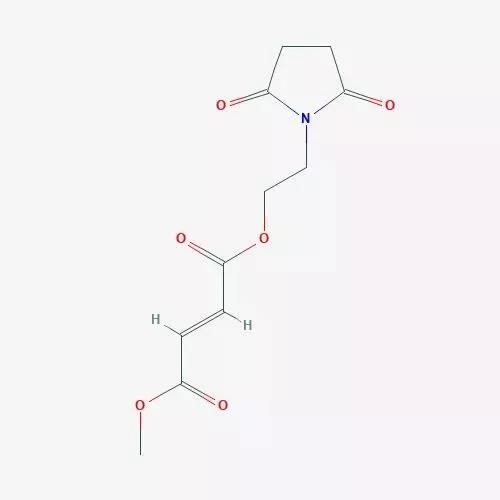
富马酸地肟酯的分子结构式(来源:PubChem)
在名为EVOLVE-MS-2的3期临床试验中,复发缓解型多发性硬化(RRMM)患者接受Vumerity或Tecfidera治疗。在试验的主要终点中,Vumerity的表现明显优于Tecifidera:根据患者的自我报告,接受Vumerity治疗的患者出现严重胃肠道副作用的天数明显少于积极对照组(p=0.0003)。而且,因胃肠道副作用而退出临床试验的患者在Vumerity组中占0.8%,在Tecfidera组中占4.8%。
Bohe Alkermes公司使用FDA的505(b)(2)监管渠道提交了Vumerity的新药申请(NDA),并使用Tecfidera作为对照药物。FDA发布的临时批准函表明,Vumerity的最终批准将在相关药物的专利保护期到期后完成。
参考资料:
[1]新药申请(NDA): 211855。检索于2019年10月15日,来自
[2]暂定批准函。检索于2019年10月15日,来自
[3]与富马酸二甲酯相比,富马酸地肟酯在多发性硬化患者中表现出显著改善的胃肠耐受性。检索于2019年10月15日,来自
关注药明康德微信官方账号
