肿瘤的免疫逃逸
在上一篇文章中,作者谈到了Munn发现IDO免疫抑制作用的过程。然而,Munn在培养巨噬细胞/T细胞时觉得色氨酸可能不是一种纯粹的营养物质,而是一种信号分子。
对于很多人来说,这种观点真的很难接受。因为我们平时吃的食物中有大量的色氨酸,色氨酸怎么会成为抑制T细胞功能的信号分子呢?
对于Munn来说,说服其他科学家接受这一观点真的不容易。当时很多科研人员只认为Munn实验室的人是一群疯子。当时只发现了色氨酸这种可以影响T细胞功能的营养素。
但后来科学家发现,包括血糖水平在内的其他营养物质的浓度也会影响T细胞的激活过程,于是人们开始接受色氨酸也可以是影响T细胞功能的信号分子。
然而,直到六年后,色氨酸抑制T细胞功能的整个信号通路才被弄清楚。然而与此同时,研究人员发现许多类型的肿瘤细胞可以表达不同水平的IDO。
更重要的是,研究人员发现,IDO1在肿瘤中的过度表达与肿瘤细胞中的Bin1状态有关。Bin1是肿瘤中最常被抑制的肿瘤抑制基因之一。研究发现,癌细胞中缺乏Bin1足以使癌细胞只利用细胞内的信号通路通过IDO1介导免疫反应逃逸。
我想大部分制药业的人都很清楚,IDO其实只是能够阻止免疫系统攻击自身抗原或者无害抗原的机制之一。在发现IDO功能的同时,科学家发现了其他参与免疫耐受的蛋白质,如CTLA4和PD1/PD-L1。
人类的免疫系统真的非常复杂。免疫系统可以持续监测外来抗原,但包括PD-1在内的一些蛋白质会抑制T细胞的功能。PD1和CTLA4可在T细胞生命过程的不同阶段表达,并抑制免疫反应。肿瘤细胞表面还可以表达PD-1的配体PD-L1,抑制免疫功能。
然而,这些检查点对于一些特定的正常生理过程非常重要,而当时的科学家发现IDO在其他组织中很少表达,IDO1基因敲除的小鼠不会产生自身免疫性疾病的症状,因此科学家觉得IDO1抑制剂的副作用可能低于PD-1/L1药物。
就是在那时,几家生物技术公司意识到了IDO在肿瘤免疫中的重要性,开始研发IDO抑制剂。事实上,在早期,大型制药公司只是持观望态度,只有Incyte和Newlink Genetics两家公司长期以来一直公开宣布其IDO R&D项目。
制药公司入场
2004年,Incyte开始了IDO抑制剂的研究项目。实际上,从药物化学的角度来看,开发IDO1抑制剂并不十分困难。I 1是一种具有催化活性的单链酶,只有包括IDO2、TDO2和TPH在内的几种其他类型的色氨酸分解代谢酶,可能没有激酶抑制剂那样难以控制化合物的选择性。
而且IDO1具有很高的组织表达特异性和很强的底物特异性。至于化合物活性的评价,测定底物色氨酸和IDO的产物犬尿氨酸并不困难。因此,开发这类抑制剂似乎并不太难。
但事实并非如此。至少Incyte在IDO1项目上的起步不是很顺利。其实在Incyte启动IDO项目的时候,人们对IDO1的作用机制还不是很了解,当时也没有很好的小分子探针来研究IDO1的功能(Munn用的探针1-MT问题很大)。
另外,如何建立复合评价体系,活动优化到什么程度,也不清楚。当时,他们筛选了30万种化合物,才找到一种适合药物化学家的先导化合物。
一年半后,该公司的药物化学家根据先导化合物合成了大约2000种化合物。通过临床前和临床前实验的筛选和优化,最终将其中一个化合物——依帕卡司他推广到临床研究。
2005年,在Incyte开始研究IDO1抑制剂后不久,Newlink Genetics也开始了IDO1抑制剂的研发。但Newlink并没有选择从零开始筛选具有IDO1抑制活性的化合物,而是选择与Munn的研究组达成合作协议,获得了最初由Munn用于研究怀孕小鼠的化合物1-MT (1-甲基-D,L-色氨酸)。
而Munn在用1-MT作为探针研究IDO的功能时,并没有对1-MT进行全面的研究,至少他没有分别对D构型和L构型的化合物进行活性测试。熟悉药物化学领域的人应该很清楚,这类异构体的药理活性有时相差很大,甚至有相反的活性。
后来发现D构型的1-MT不能结合IDO1或抑制其功能。然而,L构型与IDO1之间的结合活性较弱,因此认为L构型中的1-MT是其具有IDO1抑制活性的原因。
然而,随着研究的深入,研究人员发现,虽然1-MT对肿瘤细胞的生长有微弱的抑制作用,但1-MT实际上并不是IDO1的真正抑制剂。
经过抗肿瘤活性研究,最终证实其抗肿瘤活性实际上是由D构型介导的,其作用机制是独特的,因为研究人员发现D构型的1-MT不能直接抑制IDO1的酶活性,但可以解除对T细胞功能的抑制。
其实这是D构型的1-MT缓解色氨酸缺失导致的mTORC1活性下降的作用。其实D构型的1-MT也是我们后来熟悉的化合物indoximod。
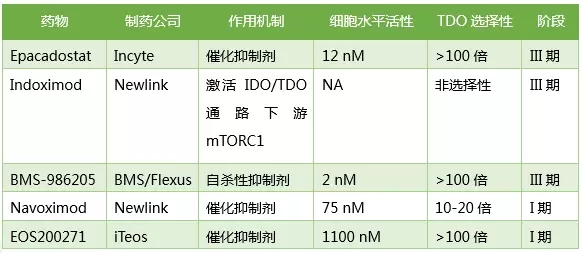
因为吲哚美辛不是一种真正的IDO抑制剂,Newlink后来发现了一种选择性更高的化合物navoximod。Navoximod在细胞水平的EC50值为75 nM,其对IDO1/TDO的选择性仅为10至20倍。因此,从这个角度来看,对于同时表达IDO1/TDO的肿瘤,navoximod可能具有一些不同于依帕卡司他的独特抗肿瘤作用。
而Incyte的依帕卡司他具有更强的12nM活性和更高的选择性。因此,在临床前和临床试验中,依帕卡司他和那伏昔莫之间可能存在一些明显的差异。
正是因为navoximod比indoximod具有更好的活性和选择性,基因泰克在2014年与Newlink达成合作协议,通过支付首付1.5亿美元和里程碑付款10亿美元的方式与Newlink合作共同开发该化合物。
除了上述两家公司,2013年由特里罗森(Terry Rosen)和胡安哈恩(Juan Jaen)创立的Flexus也是该领域的有力竞争者。他们当时成立这家公司的原因其实很简单,因为他们认为虽然在肿瘤免疫领域有PD-1/L1这样的靶点,但这个领域还有很多潜在的、被严重低估的靶点。
当他们刚开始涉足IDO领域的时候,其实已经有了非常清晰的研发思路。研究发现,这些抑制剂需要在很大程度上抑制IDO1的活性,才能产生抗肿瘤作用。而Incyte公司研发的药物剂量很高,下一次用药前血药浓度已经大大降低,他们需要寻找半衰期更长的药物。
在完成3800万美元的融资后,Flexus的科学家们很快获得了一系列IDO1抑制剂,包括作用机制独特的BMS-986205。这种化合物是IDO1的不可逆抑制剂,其药代动力学性质确实优于依帕卡司他和那伏昔莫德。
这也让他们成为很多药企的目标。经过激烈的竞争,2015年2月,BMS以12.5亿美元的惊人价格收购了这家刚刚成立18个月的公司。
然而,Flexus的IDO项目实际上有很多争议。2015年9月,Incyte起诉Flexus、Rosen和Jaen。原因是Incyte认为Flexus的核心员工Jordan Fridman是Incyte的首席科学家,Fridman是少数知道Incyte的IDO临床试验项目结果的员工之一。
Incyte曾与Fridman签订保密协议,但他们仍然认为Fridman利用这些商业秘密帮助Flexus进行IDO项目的研究,最终使得这家公司在成立仅18个月后就被BMS以天价收购。
除了BMS-986205,iTeos的PF-06840003 (EOS200271)也是一个有趣的化合物,因为它的作用机制与BMS-986205、依帕卡司他和navoximod相比有很大的不同:PF-06840003是一种色氨酸非竞争性抑制,它不与IDO1中的血红素结合。
实际上,从血红素的角度来看,BMS的抑制剂BMS-986205也是一种具有独特作用机制的化合物,因为它结合的是Apo-IDO 1而不是血红素-IDO 1。
正在研究的部分IDO抑制剂
由于活性、药代动力学性质和作用机制的差异,正在研究的IDO抑制剂的临床前/临床数据可能存在差异。
但是,无论是吲哚美辛的直接抑制活性,依帕卡司他的高选择性,对诺伏莫德的TDO/IDO1的双重抑制作用,还是BMS-986205的不可逆抑制和非血红素结合活性,还是PF-06840003的非竞争性和非血红素结合活性,血红素在疗效上是否有任何差异,差异有多大,甚至退一步讲,IDO1是否是有效的肿瘤免疫靶点,都很难从临床前得出明确的结论

ICE的IDO1抑制剂依帕卡多司他(上图)可以与IDO1中的血红素(下图)相互作用。而BMS的BMS-986205能结合非血红素apo-IDO1。资料来源:列特ACS。
谜团
其实早在发现IDO1与肿瘤的相互作用后不久,工作人员就知道单纯抑制IDO1活性并不能有效解除对免疫系统的抑制。临床研究也证实了这一点。例如,在依帕卡司他的随机II期临床研究中,发现依帕卡司他虽然耐受性良好,但疗效并不优于他莫昔芬。
2013年,肿瘤免疫学家James Allison的一项实验为IDO1和CLTA4或PD1抑制剂的联合应用奠定了基础。检查点抑制剂通常只对少数黑色素瘤患者有效,Allision发现使用Yervoy后,肿瘤细胞可以通过IDO1逃避免疫系统的监视。而CTLA4抑制剂和IDO1抑制剂的联合使用可以有效地减少黑色素瘤小鼠的肿瘤并延长其存活时间。
Allison后来发现,IDO抑制剂与PD1或PD-L1的组合也产生了类似的抗肿瘤作用。熟悉肿瘤免疫治疗领域的人应该清楚,提高检查点抑制剂的效率一直是肿瘤免疫治疗领域的热点。
去年6月,Incyte在ASCO会议上宣布了epacadostat联合pembrolizumab的临床试验结果。数据显示ORR和疾病控制率分别为35% (14/40)和63% (12/40)。从疗效数据来看,该联合方案治疗晚期非小细胞肺癌的疗效似乎优于单用检查点抑制剂。但本研究并非随机,样本量较小。
去年9月,Incyte在ESMO2017大会上公布了epacadostat联合pembrolizumab治疗晚期黑色素瘤的数据。ECHO-202研究评估了默沙东公司的依帕卡司他联合彭布罗利珠单抗治疗晚期黑色素瘤患者的安全性和有效性。数据显示患者的完全缓解率达到56%(35/63)。
但如果仔细看临床试验的PFS数据,其实很难发现试验中三类患者有什么不同。在单臂试验中很难清楚地知道药物的疗效,结合药物对单臂试验的数据进行分析就更加困难。
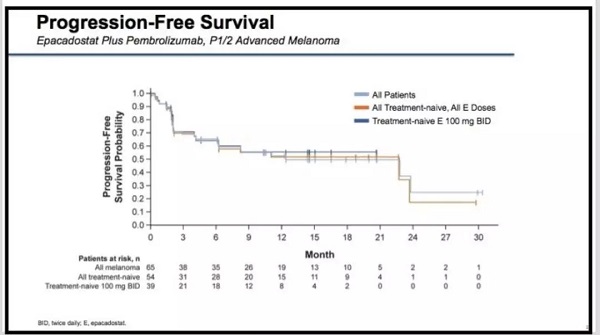
前几天公布的三期临床ECHO-301的数据可能更有说服力。与单独使用彭布罗利珠单抗相比,在治疗不可切除或转移性黑色素瘤时,依帕卡司他联合彭布罗利珠单抗未能显著改善PFS。此外,预计这项研究不会达到改善总体生存率的主要终点。这确实是一个非常危险的信号,因为如果黑色素瘤的疗效不好,其他类型肿瘤的成功概率可能就低了。
Navoximod和iTeos的EOS200271的命运同样坎坷。去年6月,由于navoximod联合atezolizumab在所有类型的肿瘤中的总体有效率仅为10%,基因泰克选择将该药物退还给Newlink。今年1月,由于疗效存疑,辉瑞也选择终止与iTeos合作研发IDO抑制剂EOS200271。
上述临床试验失败的原因可能有很多解释。首先,化合物可能有其自身的缺陷。但是对于化合物本身来说,其实这些在研药物的作用机制是不一样的,PK性质也是不一样的。比如吲哚美辛对IDO1有间接抑制作用,而EOS200271可以透过血脑屏障(这也是辉瑞选择与之合作的主要原因之一),而诺伏昔莫对TDO/IDO1的选择性作用较弱,BMS-986205是对IDO1的不可逆抑制,不与血红素-IDO1结合。这些差异很可能导致疗效/副作用的差异。
其次,合理的临床试验设计也很关键。例如,通过有效的生物标志物筛选可能有反应的潜在患者。关于这方面的内容,可以参考作者之前关于PARP抑制剂的文章。
但是临床试验失败还有一个很重要的原因,就是靶点本身有问题。其实这才是大家最担心的。这个问题我也没有答案,因为还远没有到下定论的时候。
可能现在很多人对IDO已经变得非常悲观了。其实,新药的研发本质上是一种科研探索。我们无法预测未来。即使有很大的失败概率,也会有成功的可能。还是那句话,永远抱最好的希望。
