基因治疗可以为传统治疗无法触及的疾病提供治疗选择!自2016年以来,欧盟EMA和美国FDA批准了6种基因治疗产品,包括两种针对B细胞血液肿瘤的CAR-T细胞疗法和四种针对严重单基因遗传病的基因疗法。今年,美国FDA和欧盟EMA分别批准诺华的Zolgensma用于治疗脊髓性肌萎缩症(sma),蓝鸟生物的Zynteglo用于治疗地中海贫血。如今,超过800个细胞和基因治疗项目处于临床开发阶段,可以预见,将有更多的细胞和基因疗法获准上市。最近,著名医学杂志《新英格兰医学杂志》 (NEJM)上的一篇综述盘点了这一领域的现状和未来。药明康德内容团队今天将与读者分享这篇综述的精彩内容。

基因疗法的基本原理
基因治疗治疗遗传性疾病的目标是持续表达治疗性基因或转基因,并维持足够的基因表达水平,以减轻或治愈疾病症状,同时将副作用降至最低。目前有两种基本策略:一种是利用整合载体将转基因导入干细胞或祖细胞,使转基因传递到每个子代细胞;第二种是利用非整合载体将转基因输送到长期存活的细胞中(它们可能不再分裂或分裂非常缓慢),以保证转基因能在细胞中长期表达。干细胞的转导通常发生在体外,这需要使用整合载体,而长期存活细胞的基因治疗通常使用体内基因递送。
使用体外转导策略,研究人员需要从患者身上获取细胞,引入治疗基因,然后使用类似于造血干细胞移植的方法,将这些经过修饰的细胞输回患者体内。这种策略需要基因输送载体、待输送的基因片段以及处理这些细胞的复杂技术设备。相比之下,体内基因传递系统类似于其他药物。含有转基因的载体通常是冷冻的,药剂师可以解冻制备。通常,它可以通过门诊手术进行管理。
使用基因疗法治疗遗传疾病需要的不仅仅是找到致病基因。转基因需要被输送到与生理相关的靶组织或细胞。它们需要稳定表达,并且它们必须不影响这些细胞的正常功能。
安全性考量
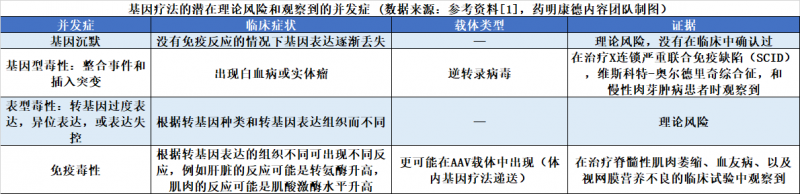
基因治疗的理论风险和观察到的临床风险(数据来源:参考文献[1],药明康德内容团队制图)
在获得与基因治疗相关的临床数据之前,研究人员已经列出了它们的潜在理论风险。临床数据的产生对这些风险的重要性进行了重新排序。现在,我们知道整合载体(如逆转录病毒载体)的主要风险是插入突变)——,它可能通过整合到细胞的DNA中而干扰DNA中原始基因的功能。对于体内递送基因治疗的载体,主要风险来自于对载体的免疫反应。
对于插入突变,降低这种风险的主要途径是设计更安全的病毒载体(如慢病毒载体)。免疫反应的风险可以通过使用辅助免疫调节药物来控制。先前研究的失败和意外不良事件的经验为这些优化措施的发展提供了重要的指导。
离体基因疗法
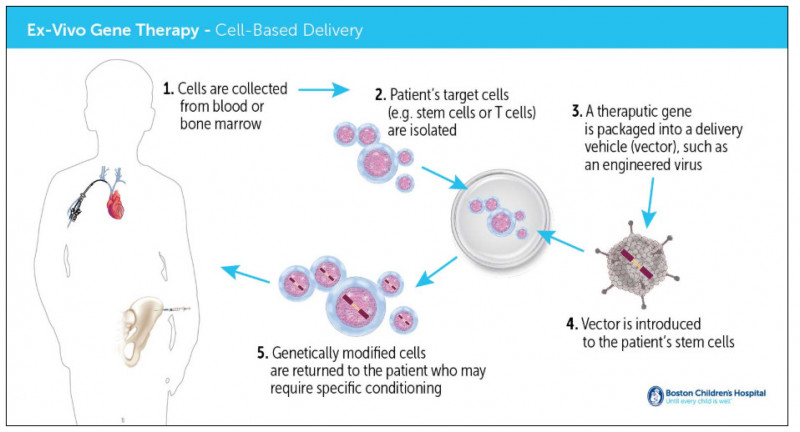
体外基因治疗示意图(来源:波士顿儿童医院官网)
治疗严重联合免疫缺陷(SCID)——我们学到了什么?
2016年,基于造血干细胞和祖细胞(HSPCs)的体外基因治疗达到了一个里程碑。EMA批准Orchard Therapeutis公司的Strimvelis上市,用于治疗由腺苷脱氨酶(ADA)缺乏引起的严重联合免疫缺陷。这种疗法使用-逆转录病毒载体,将正常的ADA基因导入患者自身的HSPCs,然后回输给患者。
20多年前,第一次用-逆转录病毒载体治疗ADA缺失型重度联合免疫缺陷症的研究没有成功,原因是输回患者体内后植入体内的HSPCs数量不足。近10年发现,为了维持ADA蛋白的长期表达,需要在移植hspc前使用低剂量白消安杀死原有的骨髓细胞,这样可以为基因工程hspc腾出空间,提高其定植水平。不幸的是,消除骨髓细胞的化疗是有毒的,这可能会增加继发性肿瘤的风险或导致骨髓衰竭。目前,研究人员正在探索其他消除骨髓细胞的方法,包括基于抗体的消除。
早期临床试验发现的另一个问题是,-逆转录病毒载体可能会在一些患者中引起T细胞淋巴瘤,导致他们需要大剂量化疗和骨髓移植。这种严重的副作用促使研究人员寻找更安全的病毒载体。
病毒缓慢整合入人类基因组的方式比-逆转录病毒载体更安全。尽管生产临床级慢病毒载体仍然是一个挑战,但基于慢病毒的体外基因治疗策略目前在许多临床试验中用于治疗免疫缺陷、代谢性疾病和遗传性血液病。
治疗地中海贫血和镰状细胞贫血症
经过研究人员30多年的努力,-地中海贫血和镰状细胞贫血的基因治疗终于看到了曙光。今年EMA批准了蓝鸟生物研发的Zynteglo用于治疗12岁以上的输血依赖型-地中海贫血(非0/0基因型)患者。研究表明,基因治疗的临床疗效与基因转导效率、转导细胞中的病毒拷贝数和基因工程HSPCs的输入剂量成正比。目前,有四个基因治疗的临床试验正在进行中,使用不同的载体针对不同的基因来治疗镰状细胞性贫血。
体内基因疗法
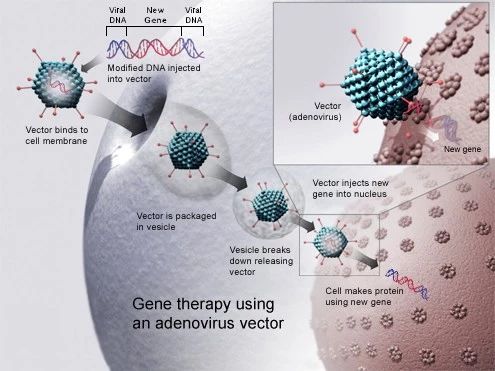
体内基因转导研究将载体直接注入患者体内,用于治疗各种单基因疾病。AAV向量是大多数研究中使用的向量。它没有致病性,不会引起强烈的免疫反应。AAV载体的局限性之一是当转基因序列大于5 kb时,转基因包装入载体的效率迅速降低。以往的临床研究发现,人体的免疫反应是系统性AAV基因治疗疗效的主要障碍。因为很多人都被野生AAV感染过,所以他们体内不仅有针对AAV的循环抗体,还有衣壳特异性记忆T细胞。开发绕过现有抗体的中和作用,控制细胞免疫反应的方法是推广AAV临床应用的关键。
第一个被批准的AAV基因疗法是由uniQure公司开发的Glybera。2012年被EMA批准用于治疗脂蛋白脂肪酶缺乏症。虽然这种基因疗法因市场需求低而在2017年被摘牌,但它的批准表明,以AAV为基础的基因疗法可以满足监管要求,从而刺激了其他AAV基因疗法的发展。
治疗视力丧失
2017年12月,FDA批准了由Spark Therapeutics开发的Luxturna,用于治疗RPE65基因突变导致的罕见失明。RPE65基因编码的蛋白酶对视觉循环至关重要。如果不治疗,这种疾病会导致大多数病人完全失明。视网膜是非常适合基因治疗的靶组织,因为它可以耐受引入的外源抗原而不产生炎症免疫反应,治疗眼科疾病所需的载体数量也相对较少。AAV载体可以在门诊手术中注入视网膜。Luxturna的批准刺激了使用类似策略治疗其他类型先天性失明的研究。目前有很多临床试验治疗各种遗传性视网膜营养不良。

全身性基因疗法递送,治疗血友病和免疫反应
通过静脉输注AAV载体,基因治疗可以靶向肝脏和其他器官。早期的临床试验试图通过血管内给药的方式使用AAV基因疗法来治疗重度血友病b患者,本次临床试验的结果发现了两大免疫学障碍:20-40%的患者已经存在针对AAV的抗体,这种抗体会中和携带者,降低疗效;在载体输入4-12周后,将出现针对AAV衣壳的延迟免疫应答。这种免疫反应将攻击转导的细胞,导致治疗效果的消失。
这两个问题的原因是人体被野生AAV感染,导致体内存在靶向抗体和记忆T细胞。
针对体内已有抗体的短期解决方案是将已有抗体的患者排除在治疗之外。显然,我们需要一个更好的方法。目前,克服这一障碍的策略包括:使用不常见的AAV亚型,人工生成嵌合AAV,或修饰AAV衣壳上触发免疫反应的蛋白抗原。
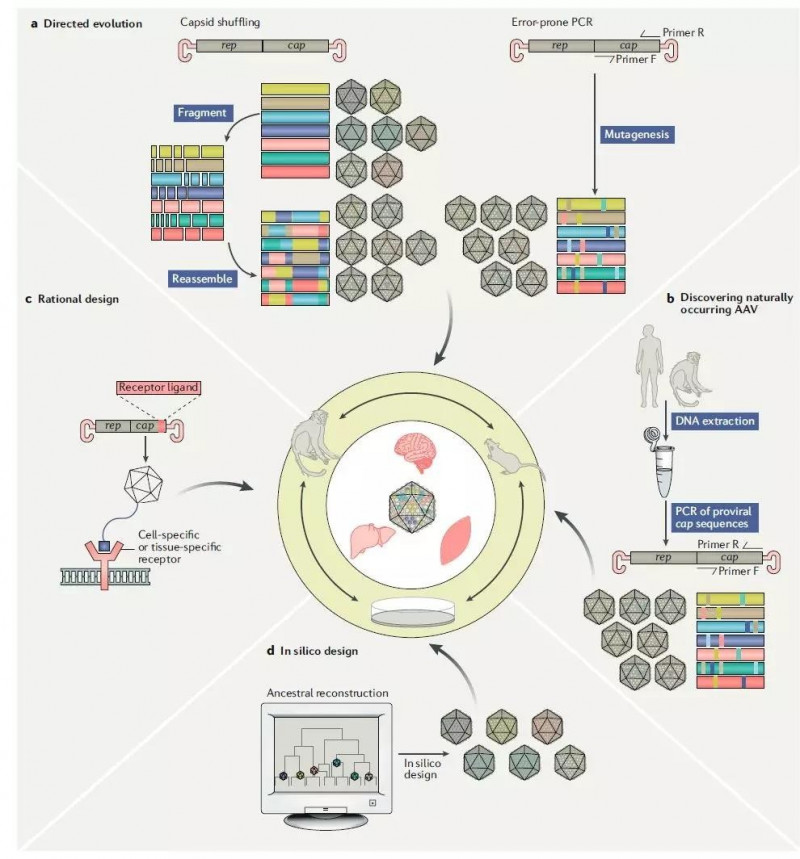
AAV载体衣壳蛋白的改进策略(来源:参考文献[2])
免疫反应延迟的临床表现是转氨酶水平升高。随后的研究表明,外周血中的单核细胞在识别与AAV衣壳相关的多肽片段后分泌干扰素。这将导致转基因表达的凝血因子IX蛋白水平逐渐降低,直至完全消失。
这一发现意味着,如果免疫系统被药物暂时抑制,可能有助于维持基因治疗的疗效,因为衣壳蛋白相关的多肽片段只是暂时出现在体内。这一假设在随后的临床试验中得到了验证,参加临床试验的患者在转氨酶水平升高或凝血因子IX水平下降时,给予糖皮质激素治疗。这使得基因疗法的疗效显著提高。
另一种降低免疫反应的方法是使用活性超过野生型的凝血因子IX变体。这使得患者在接受更小剂量的基因治疗(剂量是以前治疗的四分之一)的同时,保持更高的因子IX活性平均水平。由于免疫反应的强度与AAV载体的剂量有关,因此在后续的临床试验中,减少AAV基因治疗的剂量所诱导的免疫反应的频率也有所下降。
在血友病A的治疗中,由于编码凝血因子VIII的基因很大,将具有正常功能的转基因加载到AAV载体中是一个需要克服的挑战。目前临床试验中使用的基因疗法表达了因子VIII的“简化版本”。由BioMarin公司开发的Valoctocogene roxaparvovec在3期临床试验中取得了积极的结果,并在长达3年的随访期内显著降低了患者的年出血率和因子VIII利用率。该公司计划在今年第四季度提交监管申请。
治疗脊髓性肌肉萎缩
全身性AAV基因治疗的另一个成功案例是Zolgensma,它于今年被诺华公司批准用于治疗脊髓性肌萎缩症(sma)。SMA是一种由编码运动神经元存活蛋白的SMN1基因突变引起的罕见遗传病。根据发病时间和严重程度,可分为四个亚型。1型SMA是导致婴儿死亡的最常见的遗传因素。死亡或需要持续呼吸辅助的患者的中位年龄为10.5个月。Gensma的临床试验已扩展到100多名婴幼儿。实验结果与初步临床结果一致。
基因疗法的机遇和挑战
两个最新的监管趋势将支持基因治疗作为一种治疗模式的进一步成熟。第一个趋势是,美国国立卫生研究院(NIH)主任弗朗西斯柯林斯(Francis Collins)博士和前FDA局长斯科特戈特利布(Scott Gottlieb)博士宣布,FDA将全面负责基因治疗的审查。此前,基因治疗必须经过NIH重组DNA顾问委员会和FDA的双重审查。这一变化有助于简化基因治疗的审查程序。
另一个趋势是,FDA组织和先进疗法办公室在2018年发布了6个新的指导文件。根据该领域的经验和共识,对各种疾病的基因治疗的临床前、临床研究和生产提出标准化的指导和建议。
基因治疗的费用是可能阻碍其广泛推广的一个重要因素。以前的医保制度是针对需要长期服用的药物种类而设计的。对于所有的细胞和基因疗法来说,如何将这种可能带来长期疗效的“一次性”治疗模式纳入医保体系,是一个重要的挑战。
大多数人都同意,如果疗效相当,一次性治疗的模式比必须重复使用的药物更好。因此,一次性治疗的长期益处将证明高成本治疗的价值。血友病就是一个很好的例子。目前,血友病的标准治疗方法是凝血因子替代疗法,不仅需要患者每周接受3-4次输液治疗,而且每位患者每年的费用超过40万美元。从长远来看,血友病的新基因疗法可以为卫生保健系统节省资源。
但是,对于之前没有任何治疗手段的疾病,如何支付创新治疗的费用仍然需要解决。目前,药物开发公司也在探索多种付费模式,包括根据治疗效果付费和在维持治疗效果时分期付费。
对于体外基因治疗,未来的目标是:
1.优化慢病毒载体的设计,进一步提高转基因的安全性和可控性。
2.有效地批量生产矢量并对其进行分析和评估。
3.开发毒性更小的预处理疗法,可提高基因工程后干细胞定植水平,减少并发症。
对于使用AAV载体的体内基因治疗,下一个十年将关注以下问题:
1.进一步明确和控制人体对病毒载体的免疫反应。
2.改进AAV载体的设计,在提高基因治疗靶向输送能力的同时,减少所需治疗剂量,提高体内疗效。
总的来说,基因治疗领域的进展为许多以前无法治愈的疾病提供了令人兴奋的新治疗机会。我们期待,在制药行业不同成员的合作努力下,这种新的治疗模式能够克服现有的挑战,充分发挥其治疗潜力!
参考资料:
[1] High和Roncarolo,(2019)。基因疗法。《新英格兰医学杂志》,DOI: 10.1056/NEJMra1706910。
[2]王等,(2019)。腺相关病毒载体作为基因治疗递送平台。自然评论药物发现。
关注药明康德微信官方账号
