资料来源:《Nature Reviews Drug Discovery》
遗传性视网膜营养不良(IRDs)是一种罕见的眼病。由于患者遗传缺陷导致的视网膜进行性退化。他们通常在生命的早期或中期开始出现严重的不可逆视力丧失。超过200种基因缺陷与最常见的ird有关。
2017年,FDA首次批准了IRDs的基因治疗。由Spark Therapeutics Company开发的Luxturna(voretigene neparvovec)可用于治疗儿童和成人患者RPE65基因突变引起的IRDs。这种治疗方法也在去年11月获得了欧洲药品管理局(EMA)的批准。这些里程碑式的批准使基因治疗成为眼科疾病治疗的新模式。最近《Nature Reviews Drug Discovery》上发表的一篇文章盘点了基因疗法在眼科疾病治疗中的应用。今天,我们与读者分享精彩内容。
IRDs,基因疗法发挥威力的理想疾病领域
最常见的ird包括色素性视网膜炎、色盲、Leber遗传性视神经病变(LHON)、Leber先天性黑蒙症(LCA)、Stargardt病、色盲和X连锁视网膜劈裂症(XLRS)。从某种角度来说,IRDs是一个理想的适合基因治疗的疾病领域,因为大多数导致疾病的基因突变已经被证实,而眼睛在某种程度上是一个免疫特权区。临床试验表明,用腺相关病毒(AAV)或慢病毒(LV)载体进行眼部基因治疗不会引起全身副作用,也不会产生明显的免疫反应。
目前,大多数基因治疗的研究集中在上述ird。此外,基因疗法可以治疗的眼部疾病包括视网膜血管疾病和年龄相关性黄斑变性(AMD)。虽然这些疾病不是由单一基因缺陷引起的,但通过基因治疗修饰的细胞可以产生蛋白质来阻断疾病发生的途径。
基因疗法研发管线分析
递送眼科基因治疗的模式与目标细胞在眼中的位置有关。在大多数ird中,缺陷基因影响视网膜外层、视网膜色素上皮细胞(RPE)和脉络膜。在这些情况下,病毒载体将被注射到视网膜下空间。对于LHON来说,视网膜神经节细胞是目标细胞,因此将病毒载体注射到玻璃体腔中,以帮助渗透到内层视网膜中。由于XLRS患者视网膜的脆弱性,玻璃体内注射通常用于治疗这种疾病。
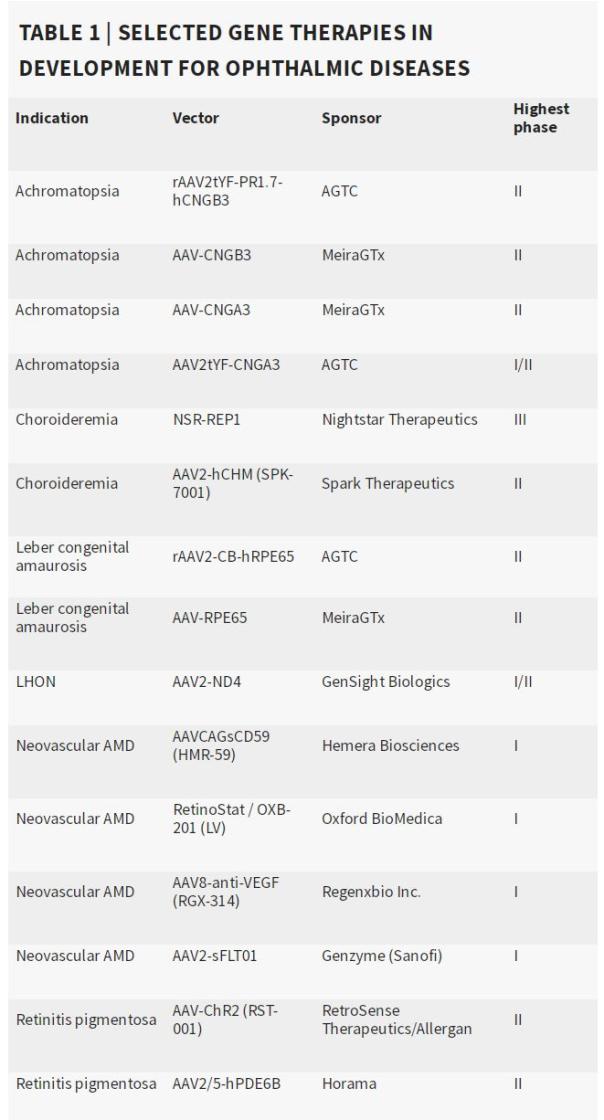
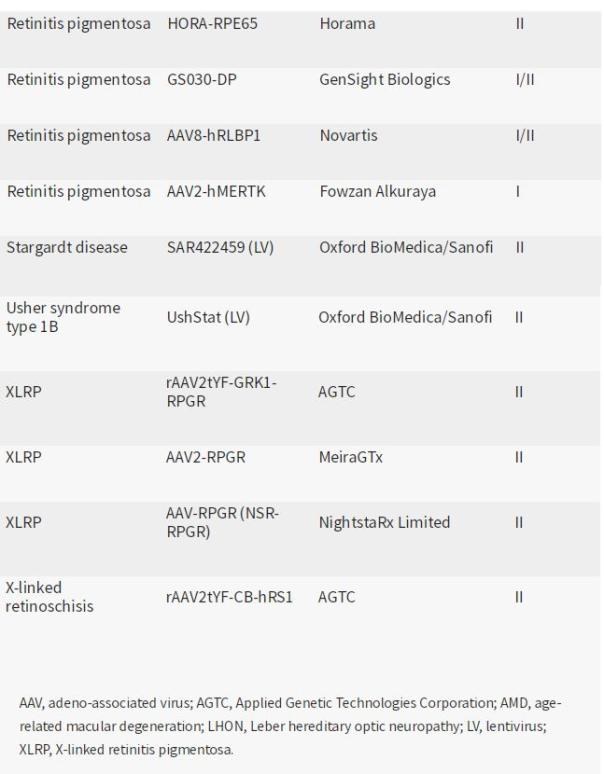
目前,有25种眼科疾病的基因疗法正在进行药物研发。其中,应用基因技术公司和MeiraGTx公司各有4-5种进行中疗法,在进行中疗法数量上处于领先地位。
在25种基因疗法中,19种处于2期临床开发阶段。视网膜色素变性有五种治疗方法,色盲有四种,LCA有两种。
大多数研究疗法的目标是引入具有正常功能的基因,从而恢复缺陷基因编码的蛋白质的正常表达。这些基因包括CHM/REP1(治疗色盲)、CNGA/CNGB(治疗色盲)、RPE65(治疗LCA)、RS1(治疗XLRS)或RPGR(治疗X连锁视网膜色素变性)。
AMD的基因治疗在这方面是个例外。这些基因疗法编码的蛋白质可以抑制血管生成或细胞死亡。例如Regenxbio公司的RGX-314表达的抗体片段可以抑制VEGF促进血管生成的活性,从而治疗湿性AMD。另一种独特的基因疗法是由RetroSense Therapeutics(已被爱建收购)开发的RST-001。这种基因疗法试图利用光遗传学的原理,在对光不敏感的视网膜神经节细胞中表达感光通道2,从而赋予这些细胞光敏感性。
目前,NightStar公司用于治疗色盲的NSR-REP1是最接近被批准的。这是一个基因疗法的三期临床试验。该疗法使用AAV2病毒载体来递送表达正常REP1蛋白的人类重组DNA。3期临床试验预计将于2020年第一季度完成全球患者注册,预计将有140名患者注册。
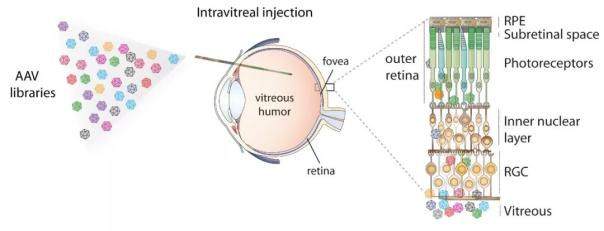
眼部注射基因治疗方法之一(来源:参考文献[2])
基因疗法面临的挑战
虽然包括Luxturna在内的第一批基因治疗成功克服了临床发展中的障碍,但未来的基因治疗仍需要面对疗法生产、临床研究设计、长期安全性研究和推广等多重障碍。在获得FDA授予的IND资格之前,基因治疗需要严格控制的生产过程和经过验证的分析和测试,以确认治疗的关键质量指标。由于基因治疗本身的复杂性,不同生产周期生产的产品在这些指标上可能会有波动。
而且,在早期的临床前研发过程中,研究人员需要进行额外的生物分布研究,以确保植入基因的表达符合预期,并且不在其他非靶组织中表达。为了帮助克服早期R&D过程中的这些挑战,FDA鼓励基因治疗开发公司在研发的早期阶段与FDA沟通。沟通渠道包括针对CBER产品的监管建议的初始有针对性的参与,这可以在IND前会议之前进行。
仔细规划临床开发可以防止开发过程中的延迟或额外试验的需要。基于1/2期或2b期临床试验的结果,基因治疗的批准通常可以通过加速批准来获得。因此,临床终点的选择、患者的入选和排除标准、临床试验地点的选择非常重要。对于基于病毒载体的基因治疗,有必要筛查患者人群是否携带针对载体的抗体,这可能会显著减少可入选临床试验的患者数量。
目前,FDA和支付机构正在寻找临床开发期间可以获得的患者体验数据。这些患者数据可以作为主要临床终点或辅助证据,支持基因治疗的批准或推广。基因治疗R&D机构需要制定相应的计划,持续收集临床R&D期间的患者经验数据和随访期间的长期安全性数据。这些措施将提高疗法研发的效率,产品的推广也可以提供协同效应。
附录:眼科疾病基因治疗部分(来源:参考文献[1])
参考资料:
[1]戈登等,(2019)。眼科疾病的基因治疗。自然评论药物发现。doi: 10.1038/d41573-018-00016-1
[2]恢复视力的简单有效的疗法:工程病毒将改善致盲眼病的基因疗法。检索于2019年1月24日,来自
关注药明康德微信官方账号
