文|周航
在体内,肿瘤不仅在细胞表面表达PD-L1以逃避免疫细胞的追捕,还分泌大量表达PD-L1的外泌体,位于细胞内的PD-L1会不断定位在细胞表面,更新和补充细胞膜上的PD-L1受体。PD-L1就像是为肿瘤细胞量身定制的实现免疫逃逸的隐身衣,对这些机制的清晰认识将更有利于肿瘤免疫治疗的不断转型和优化。
肿瘤细胞上的PD-1与肿瘤细胞上的PD-L1相互作用,抑制抗原特异性CD8 T细胞的活化、扩增和效应功能,帮助癌细胞逃避免疫破坏。PD-L1的表达响应炎症细胞因子(如肿瘤微环境中免疫细胞分泌的干扰素- (IFN-))或肿瘤细胞的内在驱动机制。
目前全世界上市的抗PD-(L)1抗体药物有5种,免疫检查点抑制剂的应用开创了肿瘤治疗的新时代。与小分子药物和其他抗体药物相比,免疫检查点抑制剂在许多适应症中显示出惊人的疗效。然而,免疫检查点封闭疗法也面临着问题和挑战。PD-1抑制剂在未经选择的实体瘤患者中的有效率仅为10%~30%,且起初治疗效果较好的患者也可能随着长期用药而产生耐药性。
现有的抗体药物可以结合并阻断肿瘤细胞表面的PD-L1,但最近的研究发现,肿瘤细胞的PD-L1仍然存在于循环内体、高尔基体和外囊泡(包括外泌体、膜颗粒和囊泡等)中。):癌细胞中的PD-L1可以促癌,也可以补充和更新细胞表面失活的PD-L1,这可能是抗体药物失效的原因之一;癌细胞会产生携带抑制T细胞活性的PD-L1的外泌体,这种外泌体会从肿瘤组织直接扩散到身体各个部位,对人体的免疫系统进行全面的攻击和抑制。
1、可对细胞膜表面PD-L1进行补充更新的内源型PD-L1
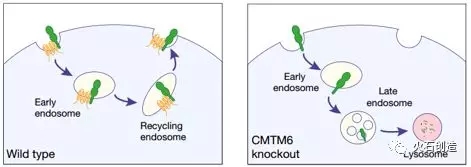
2017年,上海交大医学院附属仁济医院徐杰课题组在《Nature》发表的一篇论文中提到,CMTM6可以促进PD-L1在细胞内循环并定位于细胞膜上,间接抑制PD-L1的溶酶体降解[1],使癌细胞内的PD-L1不断循环并定位于细胞表面,使得抗体药物仅具有有限的治疗作用。
图1 CMTM6与胞吞作用PD-L1结合后会使其成为原始的。
被溶酶体降解的状态被释放,并保持在细胞表面表达的状态。
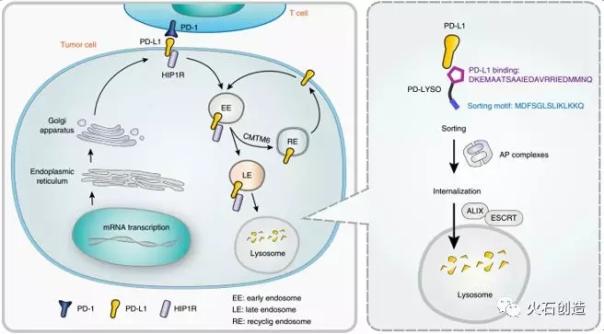
随后徐杰的实验室在杂志《NatureChemical Biology》上发表了题为“HIP1R靶向PD-L1裂解降解改变t细胞介导的细胞毒性”的研究论文[2]。发现了肿瘤免疫治疗靶向PD-L1的溶酶体降解机制,设计了新的靶向分子PD-LYSO。这种靶向药物可以促进循环中内源性PD-L1被溶酶体降解,从而间接减少细胞膜上的PD-L1,抑制肿瘤细胞的免疫逃逸。
PD-LYSO的设计原理主要基于HIP1R羧基末端的两个保守序列:
(1)PD-L1的结合区:HIP1R的796位和814位之间的氨基酸序列。在PD-L1高表达的肿瘤中,HIP1R基因的拷贝数常丢失,提示HIP1R基因可能不利于PD-L1的高表达,因此肿瘤细胞可能通过进化删除HIP1R基因。徐杰课题组对此进行了一系列的验证和研究。他们发现HIP1R对PD-L1的表达有明显的负调控作用,这种负调控作用依赖于溶酶体降解功能。
(2)溶酶体的排序序列:HIP1R的966-979位之间的氨基酸序列。这种具有“LL或LI”氨基酸序列的溶酶体分选序列负责将PD-L1定向转运到溶酶体中。本文描述了HIP1R可以通过与AP复合物结合将PD-L1转运到溶酶体表面,并依靠ESCRT复合物使PD-L1进入多囊体(MVB)和溶酶体进行降解。
图2 PD-LYSO能促进PD-L1的溶酶体降解,激活T细胞杀伤肿瘤细胞。
2、肿瘤微环境下包围着实体瘤并可扩散至全身的外泌型PD-L1
就目前的药物试验结果来看,抗PD-1和抗PD-L1抗体药物对胶质母细胞瘤的治疗效果不佳。然而,在脑肿瘤中,40%至50%是胶质瘤,而在胶质瘤中,星形细胞瘤是一种约占所有病例五分之二的肿瘤。在星形细胞瘤中,有一种最常见和最臭名昭著的细胞肿瘤类型——胶质母细胞瘤。这种肿瘤的特点是发病快,死亡率高。在肿瘤免疫治疗过程中,胶质母细胞瘤可谓是“缺油少盐”的慢性病。
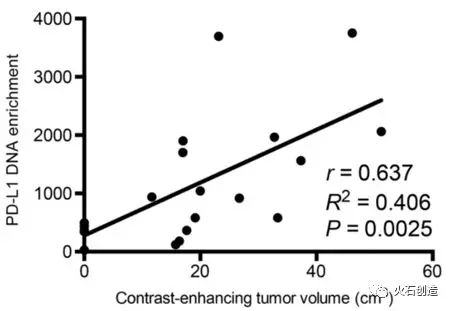
2018年3月《Science Advances》发表的一篇文章揭示了胶质母细胞瘤逃离免疫系统的一种新模式[3]。还首次发现肿瘤通过释放外囊泡(EVs)影响免疫系统。研究人员发现,肿瘤细胞可以分泌外囊泡,在外囊泡中发现了可以表达PD-L1的DNA和RNA。与7名健康人的血液样本相比,14例胶质母细胞瘤患者的血液中检测到大量能表达PD-L1蛋白的DNA,且DNA含量与肿瘤细胞大小呈正相关。
图3 PD-L1 DNA的量与胶质母细胞瘤的体积呈正相关
以默沙东的Pembrolizumab为例,在黑色素瘤中的有效率仅为33%。根据2018年8月,它被发表在《Nature》杂志上,题为“外来体PD-L1对免疫抑制的贡献”
并且与文献报道的“抗PD-1反应”有关[4],癌细胞会分泌大量PD-L1蛋白的外来体,在其表面具有T细胞抑制活性。这种外泌体就像是癌细胞释放的可以远距离作战的无人机,让癌细胞坐在免疫功能正常的体内,不被免疫细胞歼灭。
图4胶质母细胞瘤分泌的外泌体表面有大量PD-L1表达。

PD-L1的外来体抑制CD8 T细胞的增殖,削弱其分泌细胞因子和杀伤肿瘤细胞的能力。这意味着PD-L1外来体会抑制全身抗肿瘤免疫反应,导致临床效果不佳。
3、结 论
内源性PD-L1和外分泌性PD-L1都像一个资源库,不断为肿瘤细胞提供补给,使其在免疫细胞的监督下变得隐形。在肿瘤免疫治疗的未来发展中,阻断内源性PD-L1的循环定位,帮助T细胞通过肿瘤细胞包围的外分泌PD-L1,将是提高实体肿瘤疗效的关键突破口。
参考资料:
[1]BurrM L,Sparbier C E,Chan Y C,等CMTM6维持PD-L1的表达并调节抗肿瘤免疫。[J]。自然,2017,549(7670):101。
[2]hip1r将PD-L1靶向溶酶体降解,以改变T细胞介导的细胞毒性。
[3]RicklefsF L,Alayo Q,Krenzlin H,等. PD-L1成骨肉瘤细胞外泡介导的免疫逃避[J].中国免疫杂志.Sci Adv,2018,4(3):eaar2766。
[4]程,黄安春,张伟,等. PD-参与免疫抑制并与抗PD-1反应有关[J].大自然。