1、类化药临床审批概况
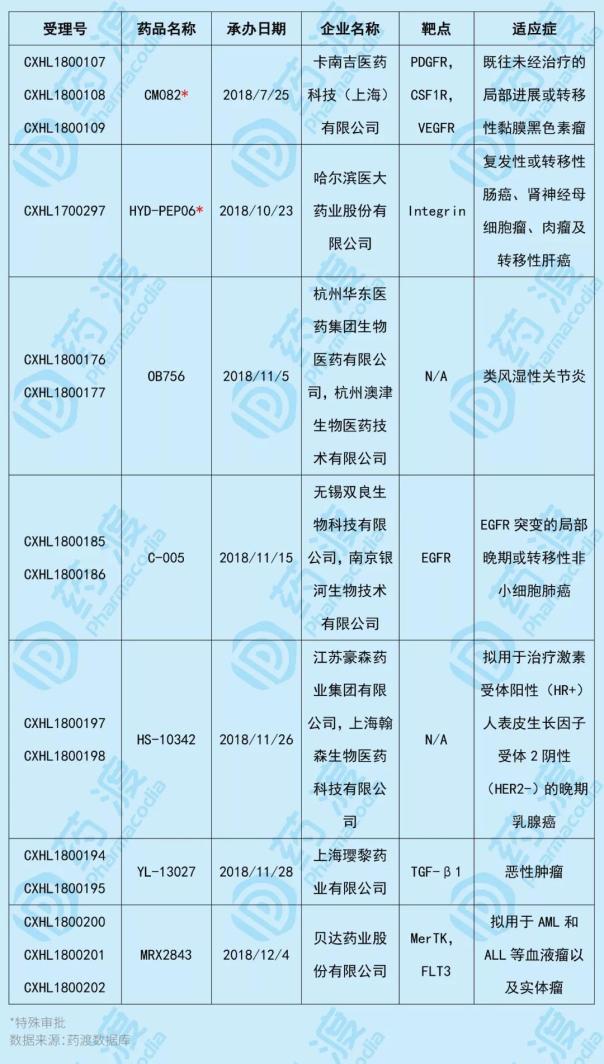
2019年1月,共有7个中国第一类化学药品获得国家医药产品监督管理局(NMPA)批准,其中2个为特殊批准品种。具体信息如下表所示:
1、CM082片
CM082片剂(Vorolanib)是一种针对VEGFR、PDGFR和CSF1R的多靶点受体酪氨酸激酶(RTKs)抑制剂,可抑制血管生成和肿瘤生长。该药的研发目标是保留辉瑞舒尼替尼的药效,并大幅降低其毒性。CM082片剂用于口服治疗湿性年龄相关性黄斑变性(wAMD)、急性髓细胞白血病(AML)和各种晚期实体瘤,如非小细胞肺癌、胸腺瘤、胃癌、肝细胞癌、肾细胞癌、黑色素瘤、胰腺神经内分泌肿瘤等。
Vorolanib最初是由Tyrogenex (R&D代码X-82)开发的。2009年,卡南吉医药获得中国R&D授权(R&D代码CM-082),春分科学获得中国以外的R&D和商业化授权。2017年6月,卡南吉药业成为贝达药业的全资子公司。2018年6月,Equinox Science成为北大的全资子公司。截至目前,贝达药业通过卡南吉拥有沃罗拉尼化合物(X-82)所有适应症的国内权益,通过Equinox拥有海外权益。此外,贝达药业的美国子公司Xcovery也在进行这种药物的临床研究。
2、HYD-PEP06
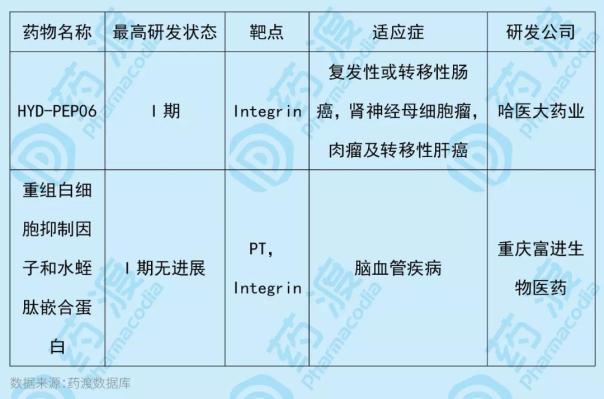
HYD-PEP06是固相化学合成的多肽类抗肿瘤药物,含有30个氨基酸,其序列为RGDRGDMHSHRDFQPVLHLVALQSPLSGGM。多肽N端重复的Arg-Gly-Asp(RGD)基序可特异性结合肿瘤相关血管内皮细胞的整合素,抑制肿瘤血管生成、肿瘤增殖、营养吸收和代谢。HYD-PEP06是恩度的RGD修饰的仿生肽。通过合成方法解决了这种一线抗癌药稳定性低、半衰期短、抗原性强的缺点。HYD-PEP06由哈医大制药有限公司研发,国内一类靶点相同的药物如下表所示:
3、OB756片
OB756由杭州华东制药集团生物医药有限公司和杭州金鳌生物医药科技有限公司研发,用于治疗类风湿性关节炎。但该药物的具体活性成分和作用靶点尚不清楚。
4、C-005片
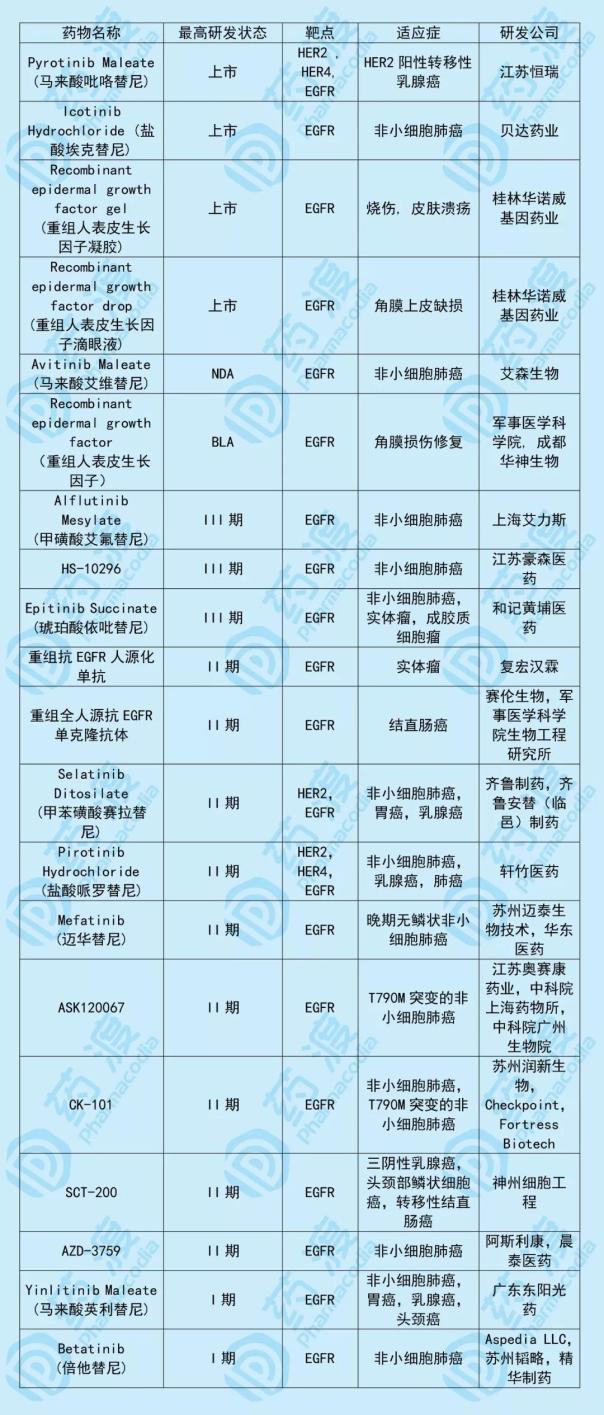
C-005是一种新型的第三代EGFR抑制剂,用于治疗EGFR突变的局部晚期或转移性非小细胞肺癌。C-005由南京银河生物和无锡梁爽共同开发,双方各拥有50%的权益。与C-005靶点相同的中国一类新药如下表所示:
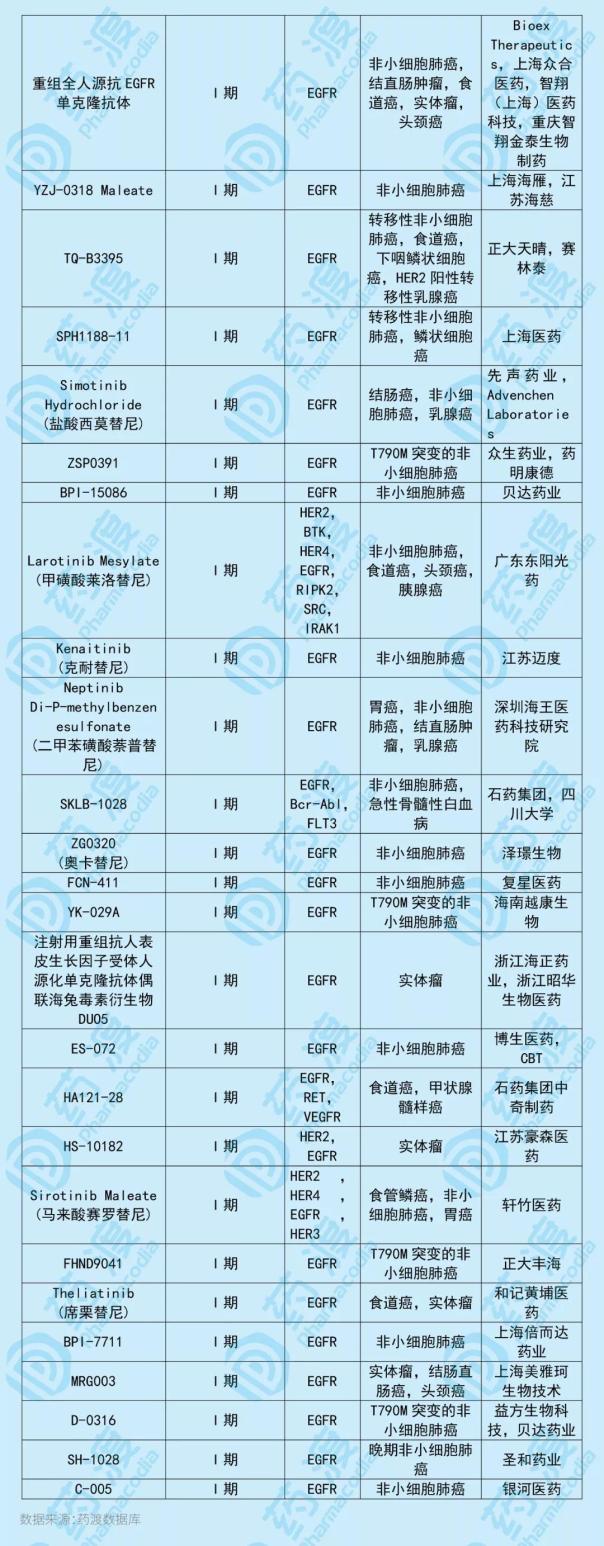
5、HS-10342片
HS-10342由江苏豪森药业集团有限公司及其子公司(上海汉森生物医药科技有限公司)研发,拟用于治疗激素受体阳性(HR)和人类表皮生长因子受体2阴性(HER2-)的晚期乳腺癌。
6、YL-13027片
YL-13027是转化生长因子1(TGF-1)的抑制剂,旨在用于治疗恶性肿瘤。与YL-13027靶点相同的中国一类新药如下表所示:
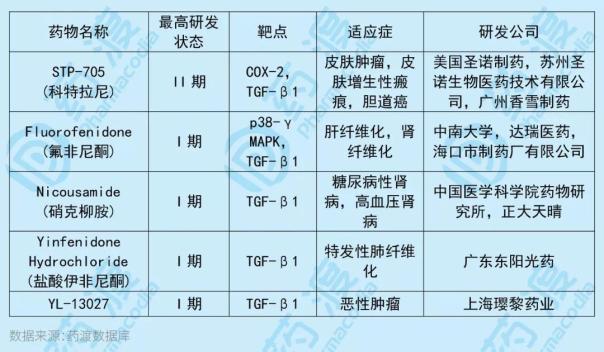
7、MRX2843片
MRX2843是一种双重抑制剂,靶向Mer酪氨酸激酶(MerTK)和FMS样酪氨酸激酶3(FLT3)。MerTK和FLT3在多种肿瘤中过表达,MRX2843可通过抑制肿瘤微环境中肿瘤细胞和先天免疫细胞上的MerTK和FLT3诱导肿瘤细胞凋亡。目前,该药物正处于治疗实体肿瘤的I期临床研究和治疗血液系统恶性肿瘤和血栓的临床前试验阶段。
MRX-2843最初是由加州大学和北卡罗来纳大学教堂山分校联合开发的。Meryx在2013年7月被授权开发该药物。2017年7月,贝达药业以200万美元收购MRX-2843在中国的权益,负责MRX-2843在中国的R&D和申报。
1类生物药临床审批概况
2019年1月,中国共有9个1类生物药获得NMPA临床默示许可,其中2个为特批品种。具体信息如下表所示:
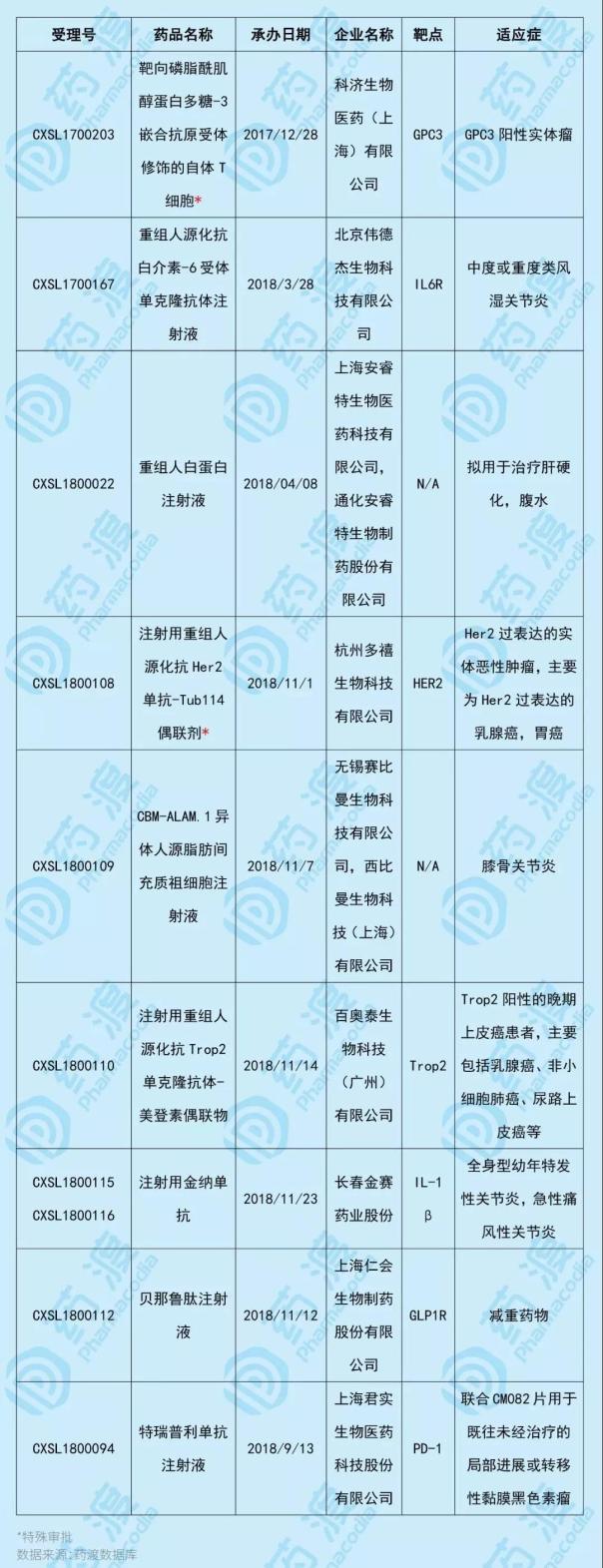
1、靶向磷脂酰肌醇蛋白多糖-3嵌合抗原受体修饰的自体T细胞GPC3-CAR-T cell)
GPC3-CAR-T细胞是一种嵌合抗原受体(CAR)T细胞疗法,旨在治疗肝细胞癌(HCC)、肺癌、乳腺癌和胃癌。磷脂酰肌醇蛋白聚糖-3(GPC3)是硫酸乙酰肝素蛋白聚糖(HSPG)家族的成员,其羧基末端通过糖基磷脂酰肌醇(GPI)锚定在细胞膜上。GPC3在肝癌细胞表面高表达,对癌细胞的粘附、增殖、侵袭和转移具有重要意义。GPC3-CAR-T细胞可以介导GPC3阳性癌细胞的靶向杀伤作用。
该产品由科济生物医药研发,与上海交通大学医学院附属仁济医院合作在国内进行一期临床试验。
2、重组人源化抗白介素-6受体单克隆抗体注射液
北京伟德杰生物科技研发的重组人源化抗IL -6受体单克隆抗体,拟用于治疗中重度类风湿性关节炎。该药物的IND申请由NMPA于2018年3月承担,并于2019年1月获得临床暗示许可。
3、重组人白蛋白注射液
安瑞特生物技术公司开发的重组人白蛋白旨在用于治疗肝硬化、腹水和其他适应症。白蛋白主要由肝脏合成,具有维持血液渗透压和营养载体的作用。传统的血液制剂存在产量低、价格高、交叉污染等缺点。基因重组技术具有巨大的应用潜力。目前,我国同类型的中国一类新药如下表所示:
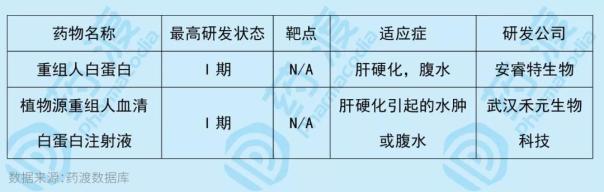
4、重组人源化抗Her2单抗-Tub114偶联剂
-Tub114偶联剂是杭州多喜生物医药研发的重组人源Her2单克隆抗体,是新一代高效低毒的抗体偶联药物(ADC)。它由重组人源化抗Her2抗体通过功能性接头与微管溶素衍生物偶联而成,将用于治疗Her2阳性实体瘤,如Her2阳性乳腺癌、胃癌、结直肠癌、尿路上皮癌等。目前,具有相同目标的中国第一类新药如下表所示:
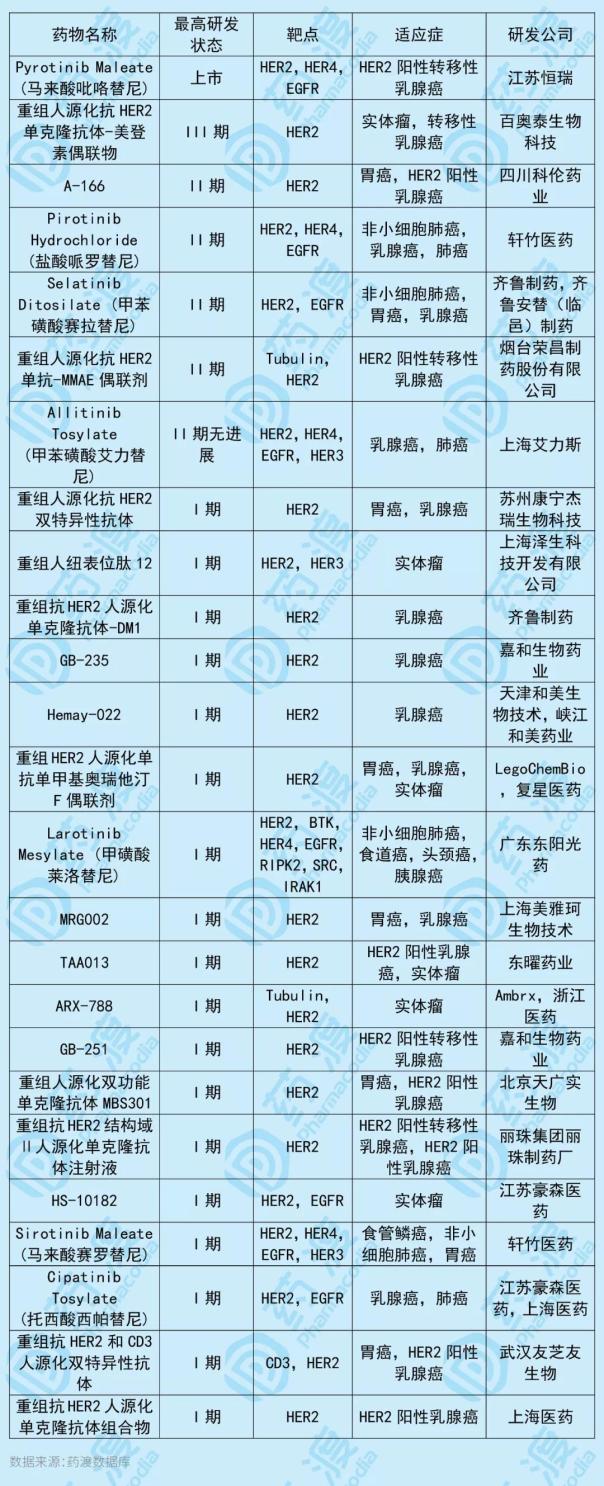
5、异体人源脂肪间充质祖细胞注射液
Biman公司开发了一种基于同种异体人脂肪间充质祖细胞(AlloJoin)的干细胞治疗药物,拟用于治疗膝关节骨关节炎。AlloJoin是中国第一个临床批准的干细胞产品,将直接从二期临床试验开始测试。
6、注射用重组人源化抗Trop2单克隆抗体-美登素偶联物
BAT-8003是BIOTAI公司开发的一种抗体偶联的靶向肿瘤相关钙信号传感器2(Trop2)的药物。它旨在用于治疗Trop2阳性乳腺癌和胃癌。Trop2是一种滋养层细胞表面抗原,这种跨膜糖蛋白参与细胞内钙信号转导,与肿瘤细胞的增殖和侵袭有关。
7、金纳单抗
Gennadizumab是一种抗白细胞介素-1-的人单克隆抗体,旨在用于治疗系统性幼年特发性关节炎和急性痛风性关节炎。它是由长春金赛制药有限公司研制的.
8、贝那鲁肽注射液
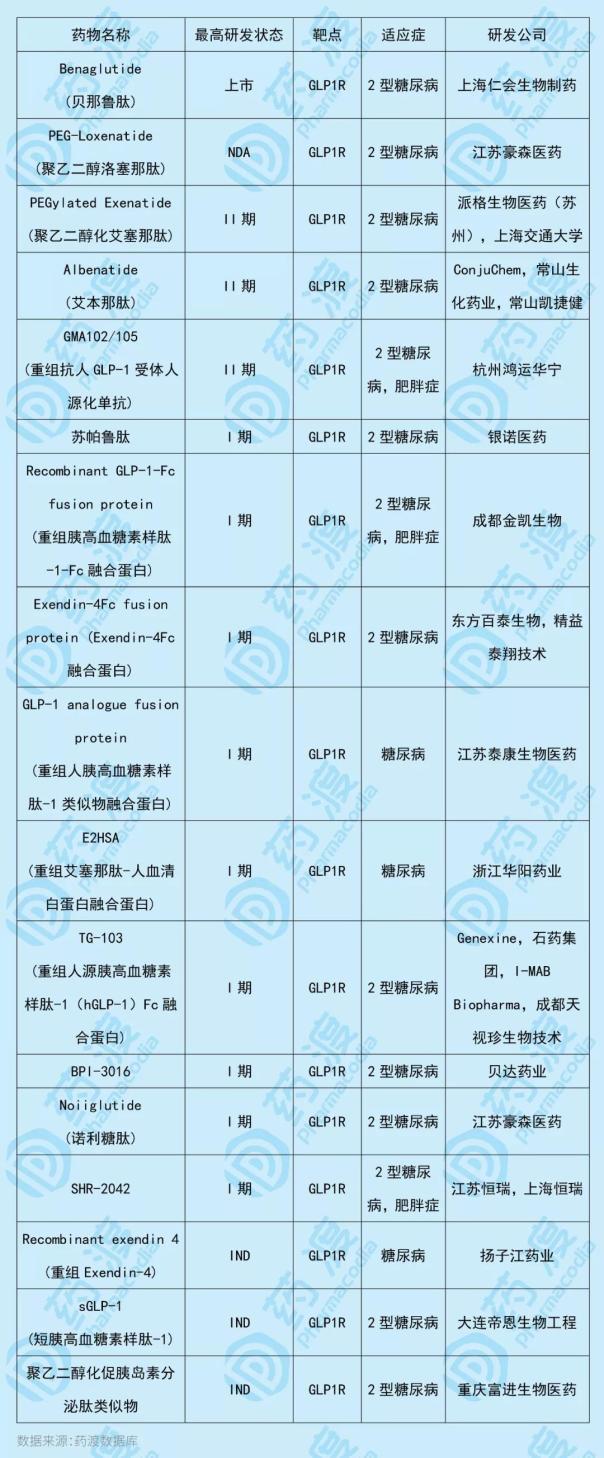
Bellutide是一种重组人胰高血糖素多肽-1(7-36),本质上是一种肠促胰岛素分泌肽。作为GLP1受体的激动剂,促进葡萄糖依赖性胰岛素的释放并减少胰高血糖素的分泌。贝露肽由上海任慧生物制药有限公司研发,于2016年12月13日获得CFDA(现NMPA)批准。它被用来治疗二型糖尿病,它的商品名称是益生泰。在以糖尿病为适应症的临床研究中,苯那肽显示出明确而显著的减肥效果。此外,用于减肥适应症的IND已于2016年7月获得FDA批准。与那鲁肽靶点相同的中国一类新药如下表所示:
9、特瑞普利单抗注射液
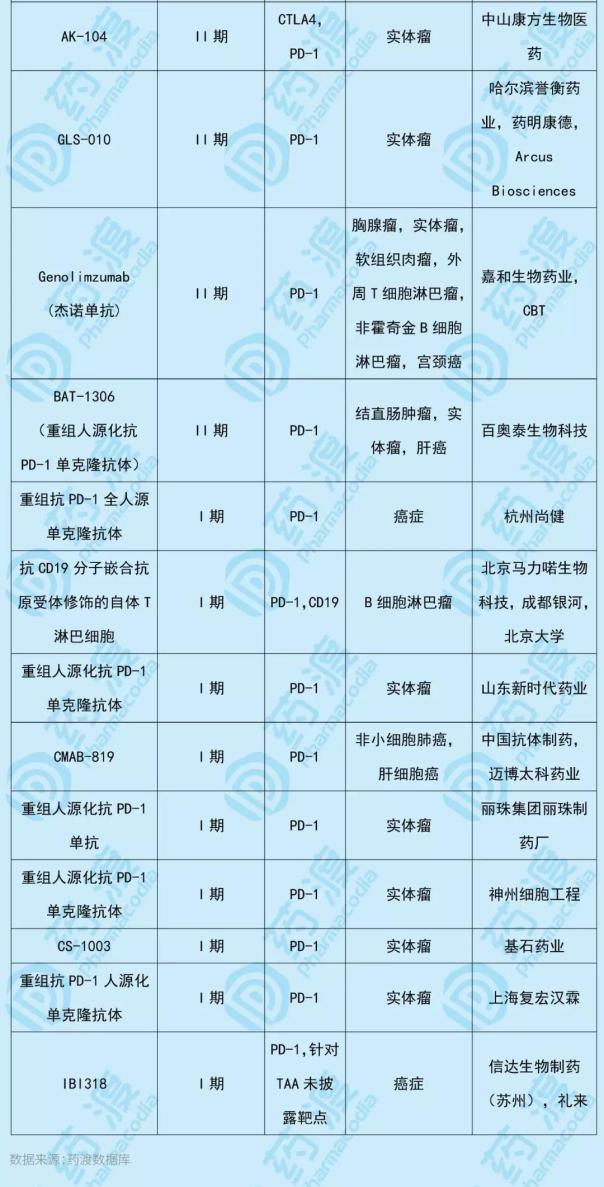
Riplizumab (JS001)是一种人源化单克隆抗体,其靶向程序性死亡受体1(PD-1)。它旨在用于治疗乳腺癌、淋巴瘤、恶性黑色素瘤、泌尿生殖器癌、肝细胞癌、食道癌和其他种类的实体瘤。2018年12月17日,NMPA有条件批准了曲普利单抗注射液的上市申请,用于治疗既往全身治疗失败后不可切除或转移性黑色素瘤患者。商品名为易拓,它成为第一个在中国独立开发和销售的PD-1单克隆抗体。此次申报适应症为黏膜黑色素瘤,在中国具有相同靶点的1类新药如下表所示:

中国1类新药NDA申请概况
2019年1月,NMPA药品检测中心承担了两项1类n的NDA申请
泽麦布是一种胆固醇吸收抑制剂,通过作用于小肠刷状缘转运蛋白NPC1LI,抑制食物和肠道、肝脏中循环胆固醇的吸收。该药由浙江海正公司研发,用于治疗原发性高胆固醇血症。
1、海泽麦布
2019年1月,NMPA承接了NDA的申请。
2018年9月,完成了2015年开始的两项临床III期试验,以评估高胆固醇血症患者单独或联合使用黑泽米的疗效和安全性(NCT03413462,CTR20150787;NCT03464682,CTR20150351).
2014年,在美国和中国分别开展了期临床研究NCT02087917和CTR20140489。
2012年11月,美国的IND申请获得FDA批准。
2012年4月提交中国化学药物1.1类IND申报,当年10月获得临床批准文件。
研发里程碑
2018年9月公布了支持高胆固醇血症患者单一药物上市的Heizemib的两项关键临床III期试验(CTR20150787,CTR20150351)的结果。这两项试验分别是多中心、随机、双盲、安慰剂对照的期临床试验和开放的长期安全性观察研究(以下简称“单药期试验”),观察黑色麦布(HS-25)治疗原发性高胆固醇血症的疗效和安全性,以及黑色麦布(HS-25)联合阿托伐他汀治疗动脉粥样硬化性心血管疾病等危重疾病的随机、双盲、双模拟、多中心观察。两项试验的主要疗效指标为12周时低密度脂蛋白(LDL-C)的下降率。结果表明,两项试验均达到预设标准,疗效与文献报道的依泽替米贝相当,不良反应轻微,安全性良好。
总共有374名受试者参加了单个III期试验。与安慰剂组相比,LDL-C的主要疗效指标下降了-14.6%(FAS组)和-16.0%(PPS组)。不良反应与安慰剂无统计学差异,短期和长期用药安全性良好。共有255名受试者参加了中间III期试验。对于常规他汀类药物治疗未达到目标值的动脉粥样硬化性心血管疾病和其他危险疾病的高胆固醇血症患者,在10mg阿托伐他汀作为背景治疗的基础上,增加一倍的黑泽米或阿托伐他汀剂量,通过FAS set分析LDL-C黑泽米降低-16.4%(PPS set为-16.8%,sub-2。在安全性方面,黑泽麦布和阿托伐他汀的不良反应发生率分别为7.9%和13.6%,黑泽麦布和阿托伐他汀的总体不良事件和不良反应频率均低于阿托伐他汀。一个
参考数据
1.海正药业股份有限公司:关于公司产品海泽麦布(Pro。2018-106)
临床结果
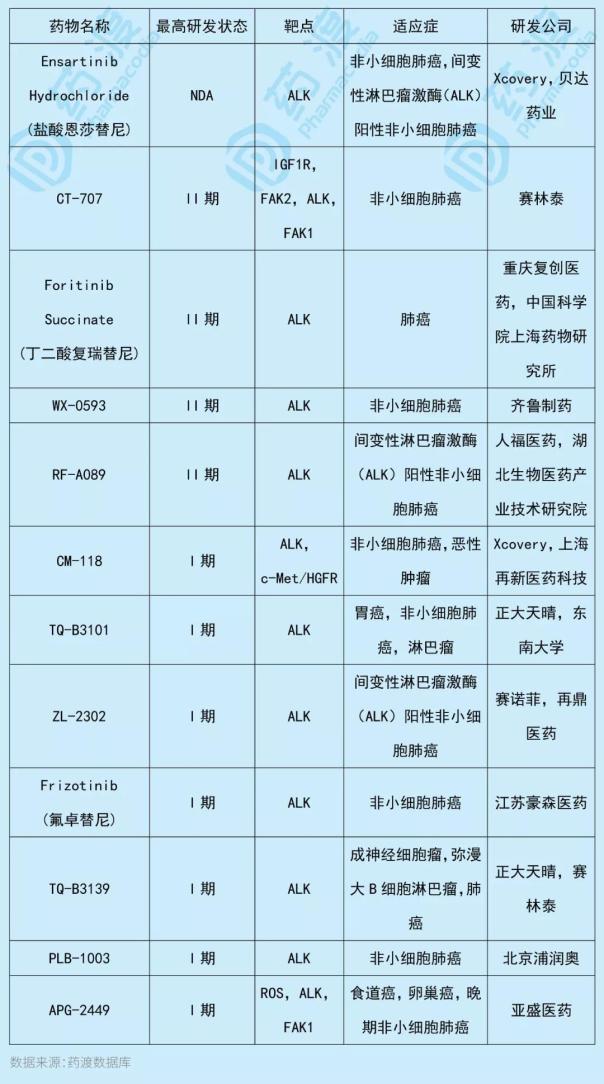
盐酸恩替尼是一种小分子变性淋巴制造酶ALK抑制剂,它也对TRKA融合、TRKC、ROS1、EphA2和c-MET具有潜在的抑制活性。ALK与染色体重排有关,其异常表达是一些非小细胞肺癌的主要标志和有效靶点。该药最初由Xcovery研发,2014年授权给贝达药业用于治疗NSCLC。
2、盐酸恩莎替尼
2018年12月26日,NMPA承接了NDA申请。
2016年6月,在美国、欧洲、澳大利亚、中国香港、以色列、韩国和土耳其开始了在ALK阳性非小细胞肺癌患者(n=402)中比较恩替尼和克唑替尼的III期研究(NCT02767804、X396-CLI-301、eXalt3、CTR20170919 ),该研究于2017年4月在日本开始,而在2018年8月,该研究仍在美国、欧洲、韩国进行
2016年10月,贝达药业、Xcovery、Cotalent在中国提交的临床申请(进口一类)由NMPA承担,2017年5月获准开展全球多中心临床期试验。
2015年11月,贝达药业向NMPA提交了中国化学药1.1类临床研究,并于2016年8月获得临床试验批文。
2012年6月,在美国启动了针对晚期实体瘤和非小细胞肺癌患者(n=100)的开放标签、剂量递增的临床I期研究(NCT01625234,X396-CLI-101,eXalt2)。
研发里程碑
2017年5月,在ELCC会议上公布了关于晚期实体瘤和非小细胞肺癌患者治疗的临床II期研究的eXalt2数据。结果显示,10例患者(9例为靶病变,1例仅为非靶病变)颅内反应的中位持续时间大于5.8个月,最长持续时间为24个月。一个
2018年3月,发表了ensatinib的I/II期临床数据。结果表明,对于新诊断的ALK阳性肺癌患者,恩替尼的有效率高达80%;对于克唑替尼耐药的患者,有效率高达69%。2
2018年6月,治疗中国ALK阳性非小细胞肺癌的I期临床结果:22例患者入选,8例患者出现3级或以上不良反应,主要为皮疹(27.3%)。在14例可评价疗效的患者中,9例为PR,3例为SD。三
2018年6月,eXalt3研究成果在ASCO会议上公布。这项研究在20个国家和98个测试中心进行。在这项全球多中心、开放标签、随机分配的研究中,约有270名非小细胞肺癌患者,他们以前没有接受过ALK TKI(ALK酪氨酸激酶抑制剂),以前最多接受过一个化疗方案,并且ALK阳性。患者随机接受恩替尼(225 mg,每天一次)或克唑替尼(250 mg,每天两次),直到疾病进展或毒性无法耐受。研究表明,恩替尼在PFS疗效指数上优于克唑替尼的概率为80%(双侧水平为0.05)。四
参考数据
1.ELCC 2017新闻:Ensartinib在ELCC 2017/05 ALK阳性非小细胞肺癌患者中证明了CNS活性。
2.Horn L,Infante J R,Reckamp K L,et (X-396)在ALK阳性非小细胞肺癌中的应用:一项首次在人类进行的I/II期多中心研究结果[J].2018年临床癌症研究:
3.Ensartinib (X-396),第二代ALK TKI,中国ALK阳性非小细胞肺癌:一项I期,剂量递增研究,ASCO,2018/06。
4.exalt 3:ACSO,2018/06,在间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)患者中比较沙替尼和克唑替尼的3期随机研究。
与恩替尼作用靶点相同的中国一类新药如下表所示: