27日,期待已久的IND(试验性新药)新政终于尘埃落定。
此后临床试验的主要流程如下:
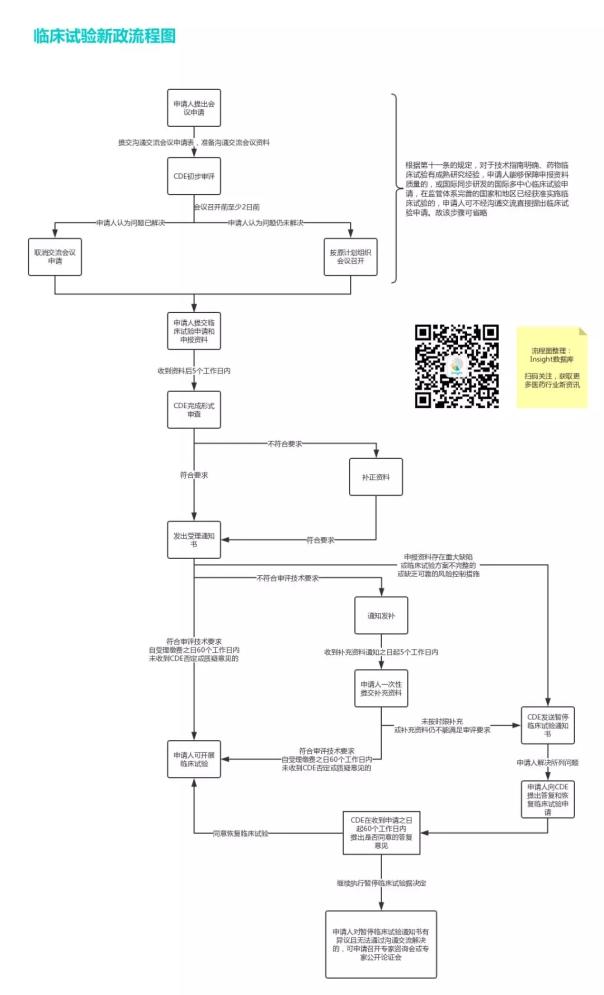
与2017年12月14日发布的征求意见稿相比,正式发布的文件有以下七大变化。
1、CDE 关于初步审评的时限没有明确
正式草案中缺少CDE初步审批时限,可能导致项目整体时间不可预测。同时,与征求意见稿相比,CDE给出初审意见与开会时间的间隔缩短。

2、60 日自申请受理并缴费之日
这也意味着企业需要支付申报费用和材料。

3、注意!提交发补的机会只有一次,且需要在 5 日内提交
在之前的征求意见稿中并没有提到作出补充的规定,这说明国家局对企业和注册部门的申请材料要求更高。企业最好一次性全部申报。毕竟5天内完成补充材料还是有难度的。
4、如果确实不符合要求,申请会被暂停,但后续仍可启动。
相比征求意见稿中“申请事项终止”的表述,新规保留了申请人继续救济的机会。

5、认可国外临床试验批准
可以省略申请会议和召开会议的步骤,直接提交IND申请,这对于国内药企和国内外同步发展的外资企业来说,无疑是一个重大利好。

6、新增适应症,重复的资料可免于提交
与征求意见稿相比,正式稿保留了部分关于新适应症的规定,但删除了40天内完成补充申请申报技术审批的时间规定。

7、细化了临床试验开展阶段的监管
相比征求意见稿,正式稿真正做到了事前、事中、事后全方位监管。
