呼吸道合胞病毒(RSV)可引起上呼吸道感染(如感冒样症状)和下呼吸道感染(如毛细支气管炎和肺炎)。它是1岁以下婴儿毛细支气管炎和肺炎的最常见原因。根据世卫组织流行病学数据,全世界每年有超过3300万例急性下呼吸道感染、超过300万次就诊和超过11万例死亡与RSV感染有关。
除了儿童,RSV感染也给老年人带来巨大的疾病负担。据美国流行病学调查,65岁以上人群因RSV感染的年死亡率为7.2例/10万人,全球每年因RSV造成的直接经济负担超过800亿美元。
因此,RSV一直是新疫苗研发领域皇冠上的明珠,但RSV疫苗在临床研发上一直以失败率高著称。在过去的十年中,RSV疫苗的研发取得了快速进展。基于病毒颗粒、载体、病毒亚单位和减毒疫苗的产品已进入临床研发阶段,成为业界关注的焦点。今年的RSV疫苗世界大会(RSVVW2019)于11月在西非国家加纳首都阿克拉举行。会议的主题是“关注新的呼吸道合胞病毒预防和治疗方法”。

RSV疫苗世界大会(RSVVW2019)
作为RSV防治领域最权威的学术会议,RS VWW报告RSV疫苗和治疗药物的最新研发状况、流行病学发现和公共卫生政策,促进全球RSV感染防治领域的进展。它一直吸引着来自世界各地的制药行业、科学界和疫情控制领域的专业人士参加会议。本次会议的与会者包括世卫组织、盖茨基金会的BMGF、国际疫苗组织的PATH、美国国立卫生研究院的NIH以及处于国际RSV疫苗或抗体研发前沿的商业公司。
本次大会的亮点是邀请了五家商业公司发布和分析临床研究进展和数据,包括Novavax的F蛋白病毒颗粒疫苗ResVax、Advaccine的G蛋白亚单位疫苗BARS13、辉瑞的Pre-F蛋白亚单位疫苗。让桑的腺病毒载体重组疫苗和阿斯利康的长效RSV预防性抗体MEDI8897是最具竞争力的产品。

Novavax公司:RSV F Maternal疫苗
Novavax于2015年底在全球11个国家的87个临床中心的4000多名健康孕妇中启动了III期临床试验。首要终点为母体免疫策略对RSV感染所致婴儿下呼吸道感染的预防效果,但最终试验未达到首要临床终点,令业界深感遗憾。

Novavax公司演讲
在这次会议上,Novavax团队从多个角度对III期研究的亚组和影响临床结果的因素进行了事后分析。结果显示,南非(共2422例)和美国(共1080例)的疫苗效力存在地区差异。美国疫苗保护效果较差可能与免疫时机、RSV基础暴露率、母乳喂养率等因素有关。Novavax表示将在未来进一步探索改进方案。

Novavaxrv疫苗的全球III期临床研究设计
艾棣维欣RSV G蛋白疫苗BARS13
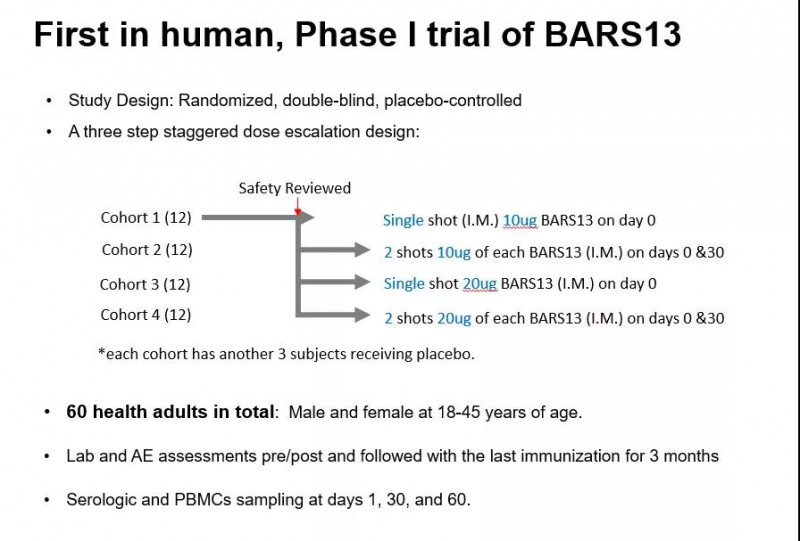
苏州Advaccine是本次大会上唯一受邀做临床进展主题演讲的中国公司。会上,其研究团队公布了澳大利亚自主研发的基于G蛋白的RSV疫苗BARS13的首个I期人体临床试验结果。
Advaccine公司演讲
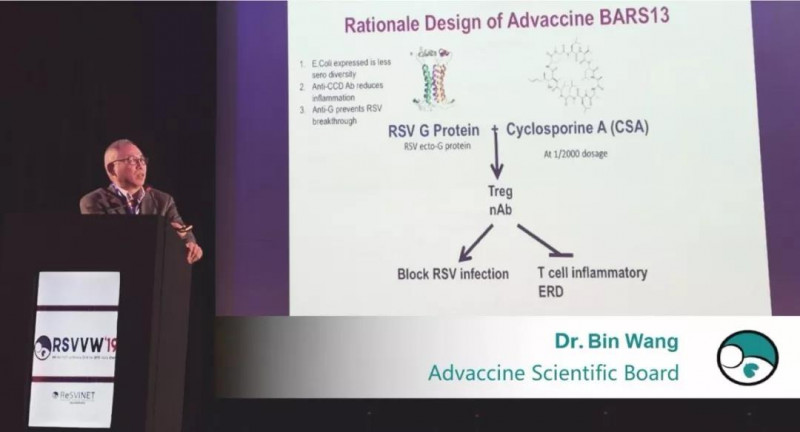
BARS13的亮点在于,它是世界上第一个为VED设计的RSV疫苗。它可以用佐剂调节Treg细胞,从而有效控制疫苗引起的炎症反应,解决RSV疫苗研制的关键安全性问题。
艾迪韦欣期临床试验设计
BARS13的I期临床试验在60名健康成年志愿者身上完成,所有剂量组均表现出良好的安全性和耐受性。在免疫原性方面,BARS13也显示出巨大的潜力。接种30天后,各组抗G蛋白抗体水平提高3-6倍。在第二次免疫后的第30天,受试者血液中的抗G蛋白抗体可进一步增加6-10倍。从受试者抗体的血清学反应比例来看,低剂量组80-90%的受试者在免疫30天后达到抗体阳性水平,高剂量组100%的受试者达到抗体阳性水平。第二次免疫后30天,低剂量组90%的受试者抗体阳性,高剂量组100%的受试者抗体阳性。
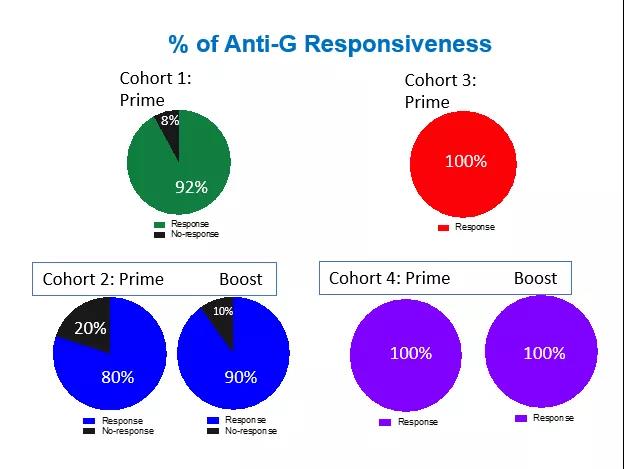
AD疫苗接种I期临床试验各组受试者抗体血清学反应比例
辉瑞RSV PreF疫苗
在Pfizer NIHd的RSVPreF蛋白研究成果的基础上,开发了一种基于PreF的新型RSV疫苗。本次大会公布的第一期I/II期人体临床试验,受试者超过1000人,包括18-49岁和50-85岁两类健康人群。主要终点是疫苗的安全性和耐受性,次要终点是疫苗的免疫原性。

辉瑞博士击败了托马斯

辉瑞RSV疫苗的基本特征和目标人群
结果表明,该疫苗表现出良好的耐受性和安全性,主要不良反应为注射部位疼痛、乏力和头痛。但在免疫原性方面,各组无明显的剂量依赖性变化,低剂量组60g与高剂量组240g刺激的中和抗体水平基本相同。
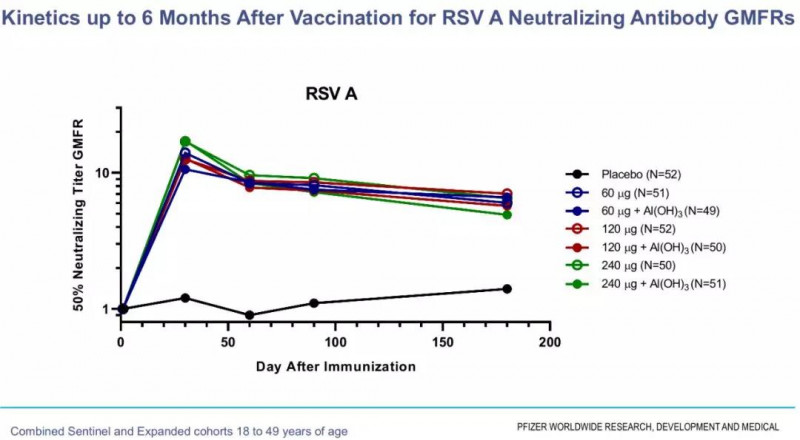
辉瑞疫苗/期受试者中和抗体水平的变化
杨森
让桑宣布了基于腺病毒载体的PreF RSV疫苗的IIb期临床试验的设计和结果。该项目此前已完成了I期耐受性和免疫效力的初步研究,以及IIa期流感疫苗的联合研究。本次会议报告了最近完成的人体挑战测试的结果。
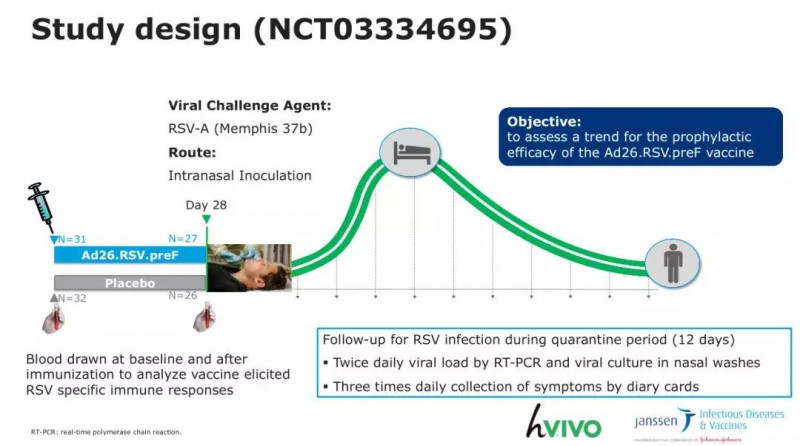
让桑期临床试验设计
共有60多名健康受试者参加了该试验。第0天接种疫苗,第28天挑战。然后随访6个月,收集受试者的RSV病毒载量、抗体水平和安全事件信息。

让桑IIb期临床疫苗保护效力终点指标
结果显示,受试者耐受性良好。疫苗效力方面,试验的终点是有无症状RSV感染的相对保护率,三个亚组的疫苗效力分别为37.7%、45.8%、51.9%。但由于各指标值的置信区间较宽,未来需要对大样本进行进一步研究。
阿斯利康MEDI8897
自从Palivizumab上市以来,许多公司持续优化中和靶点和抗体代谢周期,开发新的RSV预防性抗体。由阿斯利康和赛诺菲联合研发的MEDI8897可以通过修饰抗体的Fc段来提高产品的半衰期,从而达到在每个RSV流行季节注射一针的目标使用量(称为“类疫苗”策略)。该项目的目标人群为首次进入RSV流行季节的早产儿和足月儿,以及患有慢性肺病或先天性心脏病的儿童。这两类人群也是RSV感染的高危人群。

阿斯利康演讲
在这次会议上,阿斯利康报告了其IIb期研究。该试验在23个国家进行,超过1400名不符合Palivizumab治疗条件的早产儿(孕29-35周)入选。试验的主要终点是免疫后150天内需要药物治疗的下呼吸道感染的发生率(通过RT-PCR证实感染由RSV引起)。次要终点包括住院率、安全性事件、药代动力学、耐药抗体和药物经济学。
审判最终达到了预定的终点。与安慰剂组相比,实验组在随访期内因RSV引起的需就医的下呼吸道感染发生率显著降低。在安全性方面,两组不良反应的相关监测指标基本一致。抗药抗体监测结果显示
市场上存在巨大的未满足的需求,无论是针对RSV的预防性疫苗,还是替代Palivizumab的更优化的预防性抗体药物。对于单价较高的抗体药物,如何解决可及性问题仍将是未来的重要课题。对于疫苗,近十年来,随着业界对免疫学认识的深入,RSV研发项目如雨后春笋般出现。本次会议披露的RSV疫苗和预防性抗体项目已显示出良好的安全性和免疫原性,而许多项目正处于临床开发的早期阶段。相信在未来几年内,RSV疫苗研发领域将会有大的突破,解决这一困扰科学界和工业界几十年的重大问题。
