2018年6月,FDA批准了4种新的分子实体(NME)药物,即用于盘尾丝虫病的莫西菌素,用于复杂尿路感染的硫酸普拉唑米星,用于Lennox-Gastaut综合征和Dravet综合征的大麻二酚,以及用于恶性黑色素瘤的Encorafenib和Binimetinib的组合。CFDA批准了治疗丙型肝炎的一类新药达诺普韦钠。6月没有批准新的生物制品。
1
莫西菌素(Moxidectin)
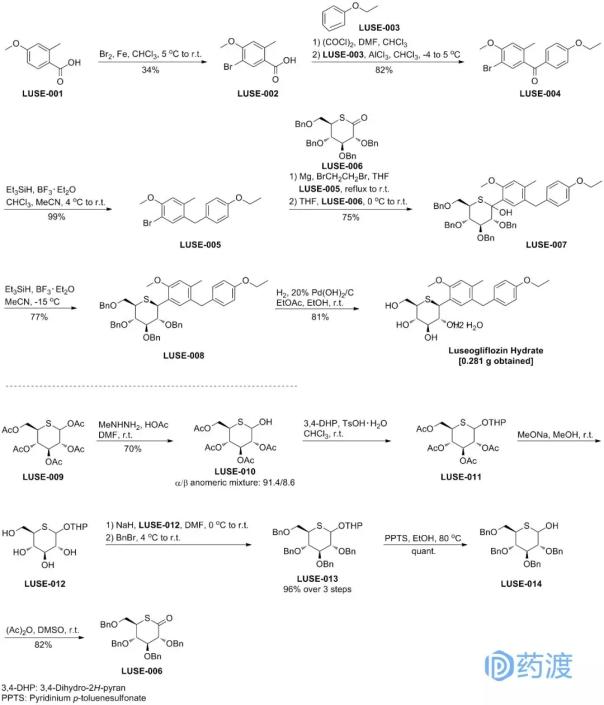
莫西地辛最初是由惠氏公司(辉瑞公司的子公司)与世界卫生组织(世卫组织)合作开发的,后来被授权给全球健康药物开发组织(MDGH)。2018年6月13日获得美国美国食品药品监督管理局(FDA)批准上市,由MDGH以商品名Moxidecin上市销售。莫西菌素被批准用于治疗12岁及以上患者的盘尾丝虫病(河盲症)[1]。该产品在20世纪90年代被用作兽药,用于治疗狗、牛、马、羊和其他动物的抗寄生虫病。这个批准就是这是莫西沙星在人体的首次应用[2]。
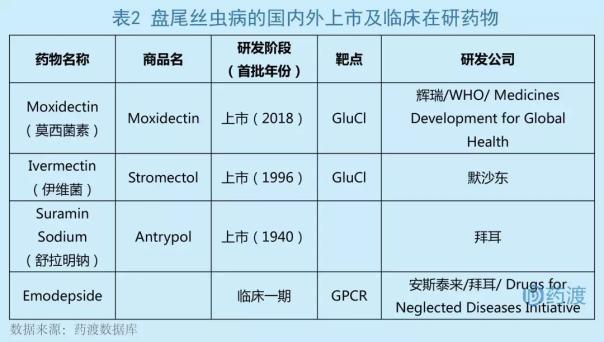
盘尾丝虫病主要发生在撒哈拉以南非洲、阿拉伯半岛和美洲部分地区。目前,只有2亿人患有这种疾病,99%以上的感染者在撒哈拉以南非洲的大约30个国家。可能是由于热带病的人群和地域的限制。目前,国内外对盘尾丝虫病的研究药物相对较少[2]。
莫西沙星对盘尾丝虫病()的作用机制尚不清楚。与伊维菌素等其他米尔贝霉素大环内酯类化合物一样,莫西沙星可能与谷氨酸门控氯离子通道(GluCl)、-氨基丁酸(GABA)受体或ATP结合盒转运蛋白结合,导致氯离子流入量增加,带负电荷的Cl-导致神经元静息电位超极化,阻止正常的动作电位释放,从而影响寄生虫。
对莫辛片治疗盘尾丝虫病的临床安全性和疗效的评估基于两项在有肠扭转的患者中进行的随机、双盲和阳性对照试验:一项是III期临床试验(试验1,NCT00790998),另一项是II期临床试验(试验2,NCT 00300768)。通过对皮肤中微丝蚴密度的分析,发现莫西沙星比伊维菌素具有明显的优势。上述两项临床试验的患者均未因不良反应退出试验。莫西沙星治疗的常见不良反应包括全身性、眼部不良反应或与Mazotti反应相关的实验室异常。这些不良反应是由于过敏或炎症宿主对微丝蚴死亡的反应。患者的微丝蚴病越严重,出现不良反应的可能性就越大[3]。
莫西沙明是米尔贝霉素大环内酯类第二代杀菌剂,比上一代抗寄生虫药伊维菌素更有效。虽然不能有效杀灭成虫,但能抑制成虫的微丝蚴释放。成为盘尾丝虫病患者的又一选择,这也是人类对抗寄生虫病战争的又一次胜利。莫西沙星的化合物专利US4916154A已经到期,其前身药物伊维菌素在许多疾病领域已经显示出非凡的潜力,因此我们期待莫西沙星在抗寄生虫疾病领域的重大突破。以旧药新用,可能是现代制药行业的一条新路。
参考资料:
[1]药物交叉数据:
(2018年6月访问)
[2]美国食品和药物管理局数据库。
(2018年6月获得)
[3]美国食品和药物管理局数据库。
(2018年6月获得)
2
Plazomicin sulfate
Plazomicin是西索米星的一种新的半合成氨基糖苷类衍生物,最初由Ionis Pharmaceutical开发,于2006年1月授权给Achaogen。该药物于2018年6月25日获得美国美国食品药品监督管理局(FDA)批准上市,由Achaogen在美国以商品名Zemdri销售。它被批准用于治疗复杂的尿路感染,包括18岁及以上的肾盂肾炎。
自20世纪40年代青霉素应用以来,新药的研发从未停止过与耐药微生物的竞争。近年来,各种“超级细菌”的病历不断出现,严重威胁人类健康。英国政府曾报道,全球约有5000万人死于耐药菌感染[5]。美国仅一年就花费约350亿美元用于治疗耐药细菌感染[6]。为了把耐药菌挡在封锁之外,对新型抗菌药物的需求更加迫切。
Plazomicin是新一代氨基糖苷类抗生素。Plazomicin与细菌30S核糖体亚单位结合,并干扰蛋白质合成的关键步骤。它的杀菌作用是浓度依赖性的。由于其结构修饰,可以防止氨基糖苷类抗生素失活酶(AMEs),包括乙酰转移酶(AAC)、磷酸转移酶(APH)和核苷酸转移酶(ANT)被破坏而失去活性。
普拉佐米星的批准主要基于一项多中心、双盲、非劣效性试验(NCT02486627),该试验达到了FDA预设的在复杂尿路感染(cUTI)患者临床研究中不劣于美罗培南的试验目标,即与美罗培南组相比,接受普拉佐米星治疗的患者在第5天的复合治愈率为88.0%比91.4。TOC的综合治愈率(当判断疗效时)为81.7%对70.1% (95% CI: 2.7,20.3),显示出统计学优势。从微生物学角度来看,意向治疗组(mMITT)的TOC基线泌尿病原体根除率为89.4%,比美罗培南组高75.5%(95% CI:6.2,21.5)。在菌血症患者亚组中,TOC时的Plazomicin复合治愈率为72.0%对56.5% (95% CI:-13.7,41.9) [7]。
Plazomicin作为新一代氨基糖苷类药物,可以避免许多氨基糖苷类抗生素失活酶(AMEs)的修饰,保持其活性。截至2018年6月,仅批准在美国上市,为复杂尿路感染患者提供了新的选择。
参考资料:
[4]药物交叉数据
(2018年6月获得)
[5]戴维斯SC;福勒T;Watson J .等人,《科学》,2013年,第381页(9878),第1606-1609页。
[6]所罗门SL;奥利弗KB,美国家庭物理学家,2014,89(12),938-941。
[7]美国食品和药物管理局数据库。
(2018年6月获得)
3
大麻二酚(Cannabidiol)
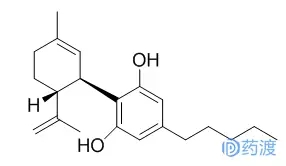
大麻二酚(CBD)于2018年6月25日获准在美国上市。这是美国美国食品药品监督管理局(FDA)批准上市的第一种含有纯化大麻提取物的新药。大麻二酚由GW Pharmaceuticals以商品名Epidiolex销售,被批准用于辅助治疗由Lennox-Gastaut综合征(LGS)和Dravet综合征(DS)引起的两岁或以上患者的癫痫发作。大麻二酚在人体内抗惊厥作用的确切机制仍不清楚。但大麻二酚已显示出镇痛、抗惊厥、肌肉松弛、抗焦虑、神经保护、抗氧化和抗精神病活性[8]。
Lennox-Gastaut综合征和Dravet综合征是两种罕见的癫痫疾病。Lennox-Gastaut综合征是一种年龄相关的隐源性或症状性全身性癫痫综合征,可由多种疾病引起,包括脑畸形、严重脑损伤、中枢神经系统感染和遗传性神经退行性或代谢性疾病。大多数患有LGS的儿童会有一定程度的智力障碍,以及发育迟缓和异常行为。Dravet综合征(Dravet syndrome),又称婴儿严重肌阵挛性癫痫(SMEI),是一种婴儿发病率高、治疗耐药性强的癫痫性脑病,常与SCN1A钠通道基因突变有关。总体发病率约为1/2万-4万,男女比例为2: 1,占儿童各类肌阵挛性癫痫的29.5%,占3岁以下婴幼儿癫痫的7%。Dravet综合征具有发病年龄早、发作类型多、精神损害严重、药物治疗效果差的特点。此外,大多数人将发展为中度至重度精神和发育残疾,需要终身监督和护理[9]。
大麻二酚治疗Lennox-Gastaut综合征的临床安全性和疗效评估基于两项随机、双盲、对照试验。在14周的治疗期间,大麻二酚组的癫痫发作减少的中位数更显著(44%比22%,p=0.0135),达到了研究的主要终点。此外,患者对大麻二酚治疗具有良好的耐受性,安全性与报道结果一致。大多数不良事件是轻度或中度的[10]。
大麻二酚治疗Dravet综合征的临床安全性和疗效评估基于一项随机、双盲、安慰剂对照试验。经过4周的观察,患者接受了14周的大麻二酚或安慰剂治疗。结果,大麻二酚组的发病率从每月12.4次下降到5.9次,安慰剂组的发病率从每月14.9次下降到14.1次。大麻二酚组有43%的患者发病率减半,而安慰剂组只有17%的患者发病率减半。另外5%的患者使用大麻二酚后癫痫消失,而安慰剂组没有[10]。
大麻二酚是FDA批准的第一个含有纯化大麻提取物的新药,用于两种罕见癫痫疾病Lennox-Gastaut综合征和Dravet综合征的辅助治疗。除了针对Lennox-Gastaut综合征患者的另一个重要治疗方案外,该药物还为Dravet综合征患者带来了首个获批的新药,这将为他们的病情带来重要且急需的改善[11]。
参考资料:
[8]药物交叉数据:
(2018年6月获得)
[9]GW制药官网:
(2018年6月获得)
[10]林业发展局数据库。
(2018年6月获得)
[11]美国食品和药物管理局批准了第一种含有从大麻中提取的活性成分的药物,用于治疗罕见的严重癫痫:
(2018年6月获得)
4
Encorafenib、Binimetinib
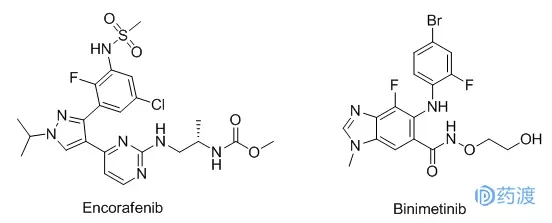
2018年6月27日,美国美国食品药品监督管理局(FDA)批准了Array BioPharma提交的上市申请,通过联合应用Encorafenib和Binimetinib治疗BRAF V600E或V600K突变的不可切除或转移性黑色素瘤。Encorafenib是丝氨酸/苏氨酸蛋白激酶BRAF抑制剂,Binimetinib是丝裂原激活蛋白激酶MEK1/2抑制剂,BRAF和MEK是调节MAPK信号通路(RAS-RAF-MEK-ERK)的关键蛋白激酶,可被不同的分子信号激活。进而将上游信号通过磷酸化传递给下游反应分子,最后将细胞外刺激信号传递给细胞和细胞核,从而引起细胞增殖、分化、转化和凋亡等生物反应[12]。
黑色素瘤又称恶性黑色素瘤,是一种来源于黑色素细胞的恶性肿瘤。近年来,它已成为所有恶性肿瘤中增长最快的肿瘤,年增长率为3%-5%。根据Globaldata黑色素瘤疾病报告统计,2016年全球黑色素瘤市场规模为83.8亿美元,预计2023年市场规模将达到412.64亿美元,年复合增长率为42.3%。我国黑色素瘤发病率较低,但近年来呈快速增长趋势。每年新增病例约2万例,死亡率也在逐年快速上升。近年来,晚期黑色素瘤的治疗取得了突破性进展。除了传统的化疗,免疫治疗和靶向治疗是目前的热点。表1列出了目前上市的黑色素瘤免疫疗法和靶向治疗药物。
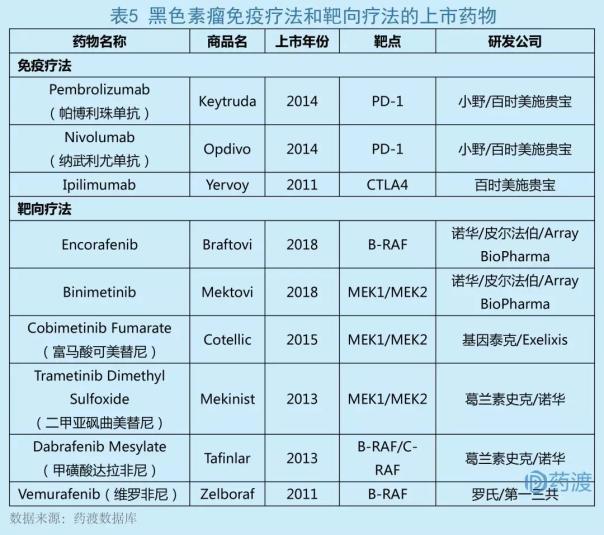
Encorafenib和Binimetinib靶向联合治疗的批准是基于一项关键的临床III期试验数据(COLUMBUSNCT01909453),旨在评估Encorafenib Binimetinib联合疗法在治疗BRAF V600E或V600K突变的不可切除或转移性黑色素瘤以及单独使用verofinib或Encorafenib的疗效和安全性。结果显示,Encorafenib Binimetinib组合的无进展生存期(PFS)在统计学上显著提高。与Encorafenib Binimetinib组、Encorafenib单药组和verofinil单药组相比,中位无进展生存期(mPFS)分别为14.9个月、9.6个月和7.3个月[13]。
根据美国NCCN黑色素瘤诊疗指南,临床上主要联合使用针对BRAF V600突变的一线靶向药物,包括曲美替尼(dalafinib)和曲美替尼(Trametinib)、Vemurafenib (verofinib)和Cobimetinib (cometinib)。Encorafenib Binimetinib联合治疗的批准为BRAF突变的黑色素瘤患者提供了一种新的治疗选择。目前,这种联合疗法也正在进行西妥昔单抗治疗转移性结直肠癌的临床III期研究。这项临床试验尚未完成,但ArrayBioPharma官网已于2017年9月披露了部分结果,其联合治疗的客观缓解率(ORR)为41%。
参考资料:
[12]药物交叉数据:
(2018年6月获得)
[13]赖因哈德D;保罗A A海伦J . G,等。2018, 19(5), 603-615
5
达诺瑞韦钠(Danoprevir sodium)
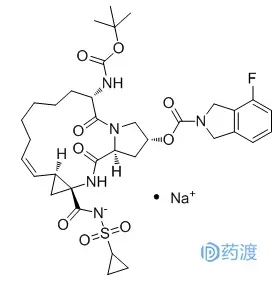
达诺病毒钠(又名达诺病毒钠)于2018年6月8日经中国药品监督管理局批准上市,由格力药业上市销售,商品名为Gonivirus。那利韦钠是HCV NS3/4A蛋白酶的抑制剂,戈尼韦被批准与聚乙二醇干扰素和利巴韦林联合用于治疗丙型肝炎。该化合物最初由InterMune和Array BioPharma联合开发,并于2006年授权给罗氏。2010年,InterMune将达那韦钠的全球开发和商业化权利出售给罗氏。2013年,罗氏将中国R&D权利授权给格力。2014年,InterMune被罗氏收购[14]。
Array BioPharma和InterMune在WO2005037214中首次公开了达那韦钠。虽然没有具体要求保护的化合物,但是马库什结构涵盖了达纳韦钠,例如化合物AR00334191(第178页)。在美国,WO2005037214已经获得US07491794授权,专利期限延长US154后,专利于2025年11月到期。在国内,WO2005037214已获CN102020697授权,专利权于2024年10月到期。罗氏随后提交了一些与达那韦钠制剂相关的申请:WO2008128921、WO2009080542、WO2009124853和WO2010015545。
丙型肝炎是一个公共卫生问题。根据世界卫生组织的估计,有1.15亿人慢性感染HCV,每年还有300万到400万新增感染。这是一个非常大的市场,约75%的病例未能得到及时诊断和治疗,成为慢性症状[15]。HCV疫苗的发展受到几个挑战的阻碍,包括病毒变异和不完全的天然免疫。尽管进行了几十年的研究,疫苗的开发并不成功。作为一种不含干扰素的治疗方法,达立韦钠由中国公司在中国推向市场,格力在中国营销产品比其他公司更有优势。但该药目前仅在中国获批,罗氏已于2017年4月停止远东以外的开发。百时美施贵宝的Daklinza和Sunvepra的组合是中国批准的第一个全口服无干扰素治疗方案。其他产品包括中国的HCV fast track,包括吉利德的Harvoni和艾比的Viekira Pak吉利德预计将于2018年至2019年在中国推出产品。未来那利韦钠的销售会面临很多挑战。
参考资料:
[14]药物交叉数据:
(2018年6月获得)
[15]世界卫生组织:(2018年6月获得)