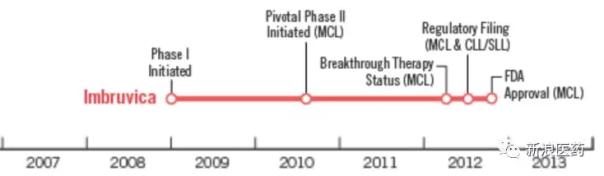
陈文达
最近,FDA授予百济神州在zanubrutinib中抑制布鲁顿酪氨酸激酶(BTK)的突破性疗法,用于治疗之前接受过至少一次治疗的成人套细胞淋巴瘤(MCL)患者。2018年8月,中国国家医药产品监督管理局接受了zanubrutinib作为复发/难治性MCL患者潜在疗法的新药申请。
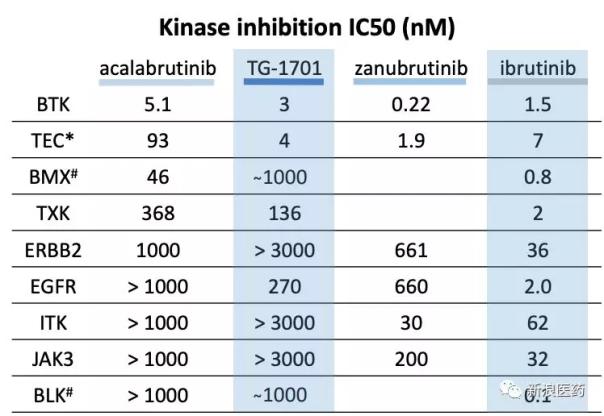
几种BTK抑制剂的体外激酶活性比较
布鲁顿蛋白激酶(Bruton protein kinase,BTK)是B细胞受体途径的重要信号分子,在B淋巴细胞的各个发育阶段均有表达,参与调节B细胞的增殖、分化和凋亡,在恶性B细胞的存活和扩散中起重要作用。
Ibrutinib是世界上第一个BTK抑制剂,它不仅抑制BTK,还抑制EGFR、JAK3、HER2等。它们是Tec家族的成员,导致出血风险、腹泻、皮疹和其他副作用。Acalabrutinib是第二代不可逆BTK抑制剂,提高了BTK的选择性,而对ITK和EGFR的抑制活性下降数百倍,对Tec的抑制活性下降十倍以上。Zanubrutinib也是第二代不可逆BTK抑制剂,BTK选择性再次提高。从体外激酶活性的数据来看,zanubrutinib确实是研发后期BTK活性和选择性最好的抑制剂。
Zanbrutinib临床开发计划

Zanubrutinib的全球开发计划主要包括:比较伊布替尼用于WM,比较苯达莫司汀/利妥昔单抗用于CLL的初始治疗,联合GAZYVA(obinutuzumab)用于难治性复发性滤泡性淋巴瘤和B细胞血液肿瘤;在中国,单药主要用于难治性和复发性MCL、难治性和复发性CLL/SLL、西医、难治性和复发性弥漫性巨大B细胞淋巴瘤和B细胞血液肿瘤。
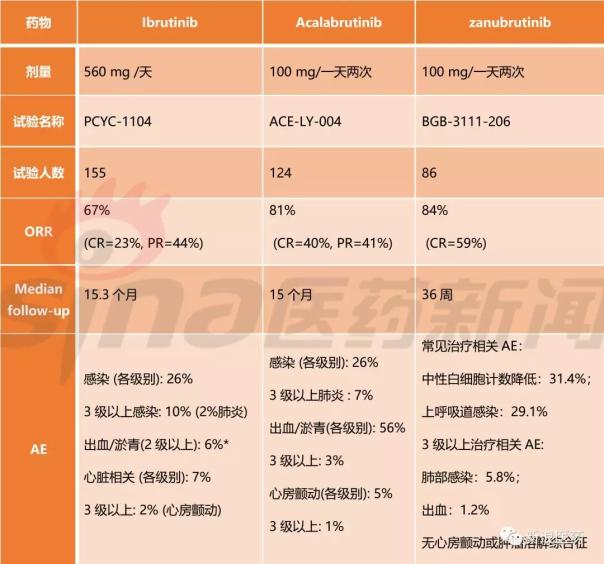
1、FDA授予突破性疗法认定的MCL二线疗法
目前,批准用于该适应症的两种BTK抑制剂是Ibrutinib和Acalabrutinib。第一个批准的Ibrutinib的ORR最低,但它是一个经过三次治疗后复发的中位患者。Acalabrutinib和Zanubrutinib在入组时相似,都是中位数两次治疗后复发的患者,ORR相似,但Zanubrutinib are率占优势,3级以上不良反应率低。目前还没有头对头的临床试验,无法证明哪种药物更有效,但Zanubrutinib能被MCL批准上市应该是必然的。
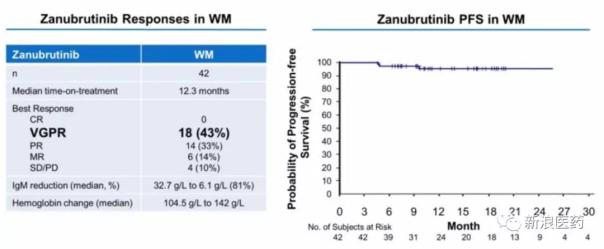
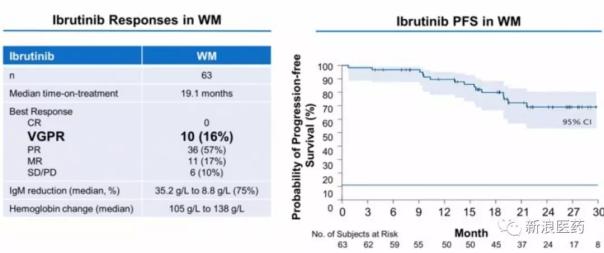
2、另一个进展较快的华氏巨球蛋白血症(WM)
由于未成熟WM细胞的过度产生,WM患者抑制其他血细胞的产生。2015年1月,伊布替尼被FDA批准用于治疗WM。基于I期试验结果,Zanubrutinib于2018年7月获得FDA对此适应症的快速通道,并计划通过快速审批于2019年初申请上市。与伊布替尼相比,良好部分缓解率(VGPR)和IgM降低率更高。
3、CLL才是要和ibrutinib争夺的主要市场
让我们来看看伊布替尼CLL的批准历史。2014年2月,Imbruvica被批准用于在过去接受过至少一种治疗的CLL成年患者。这是基于名为PCYC-1102的IB/2期试验。ibrutinib作为单一药物用于新诊断和难治性复发性慢性淋巴细胞白血病CLL/小淋巴细胞淋巴瘤SLL患者。然而,最终的批准是基于48名接受420毫克/天的CLL患者的结果。中位随访时间为15.6个月,有效率达58.3%,最长持续24.2个月。基于优良ORR的快速批准也为伊布替尼单药的CLL活性奠定了基础。
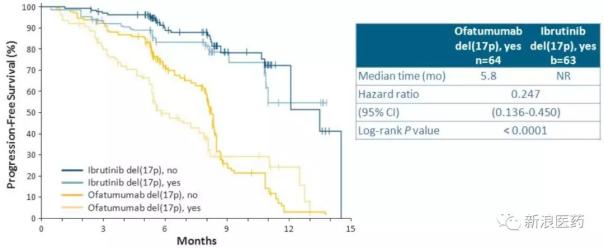
2014年7月,FDA批准其用于17号染色体(17p缺失)缺失的CLL成年患者。这一批准是基于对接受治疗的CLL患者(包括那些有或没有17p缺失的患者)的III期临床试验中,名为PCYC-1112 resonant的Ibrutinib 420mg/天与Arzerra(ofatumumab)的比较。试验在中期分析时提前结束,与Arzerra组相比,ibrutinib组的PFS显著增加(中位数为vs. 8.1个月,HR在127名17p缺失患者中,PFS也显著改善(中位数为vs. 5.8个月,HR=0.247)。这一突破性疗法获得批准,确立了伊布替尼在CLL二线治疗中的地位。61-83%的新诊断CLL患者携带17p缺失或P53突变,一些患者在治疗复发后获得17p缺失或p-53突变。Arzerra于2013年11月获得FDA批准,通过突破性疗法用于未经治疗的CLL患者,这是第一个针对CLL的CD20单克隆抗体。但目前Arzerra作为一线治疗标准一直在变,一直局限于难治性复发患者。
2016年3月被FDA批准用于CLL患者的一线治疗。基于名为Resonate-2 (PCYC-1115)的Ibrutinib与Chlamybucil(苯丁酸氮芥)对65岁以上新诊断的CLL或SLL患者进行比较的III期临床试验,该试验不包括17p缺失突变患者。
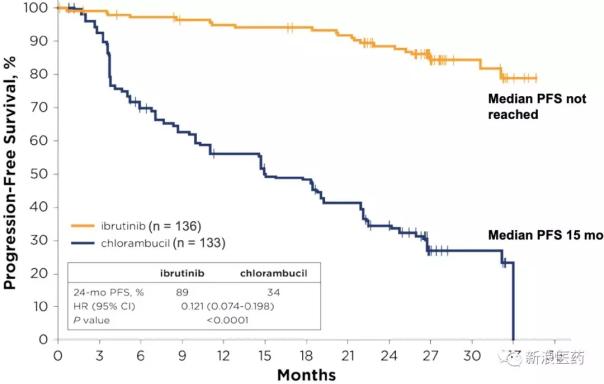
伊布替尼组患者的无进展生存期明显长于苯丁酸氮芥组(伊布替尼组为18.9个月,苯丁酸氮芥组为18.9个月),疾病进展或死亡的风险为84%,低于苯丁酸氮芥组(HR=0.16)。Ibrutinib显著延长了总存活时间。伊布替尼组患者的估计24个月生存率为98%,苯丁酸氮芥组患者的估计24个月生存率为85%。乌替尼组的死亡风险为84%,低于苯丁酸氮芥组(HR=0.16,P=0.001)。
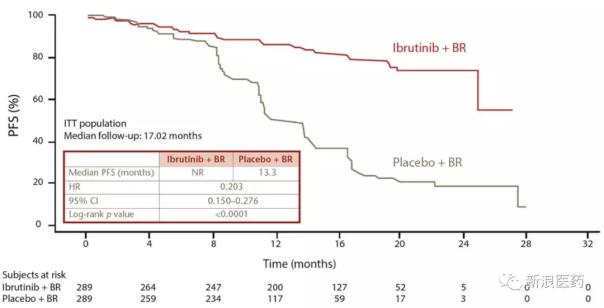
2016年5月,Imbruvica被批准与苯达莫司汀利妥昔单抗(BR)联合用于治疗成年CLL/SLL患者。根据名为HELIOS的批准试验,与安慰剂BR治疗组相比,Imbruvica BR三联疗法治疗组显著降低了80%的疾病进展或死亡风险(中位PFS小于13.3个月)。
2018年11月,Imbruvica提出了一项补充申请,用于治疗之前未接受过治疗的CLL/SLL成年患者,联合使用罗氏抗癌药Obinutuzumab (Otuzumab)。根据III期临床研究的说明数据,与苯丁酸氮芥Obinutuzumab方案相比,Ibrutinib Obinutuzumab方案显著延长了PFS,达到了研究的主要终点。
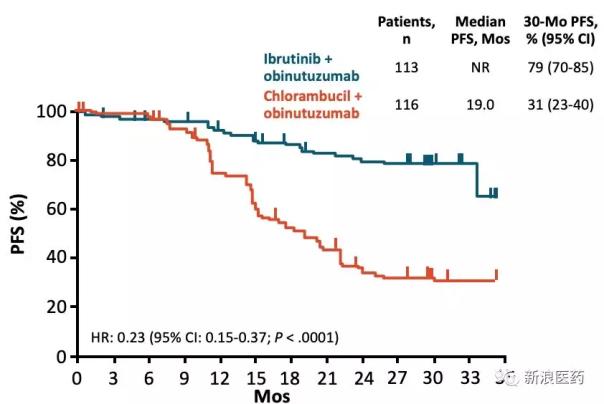
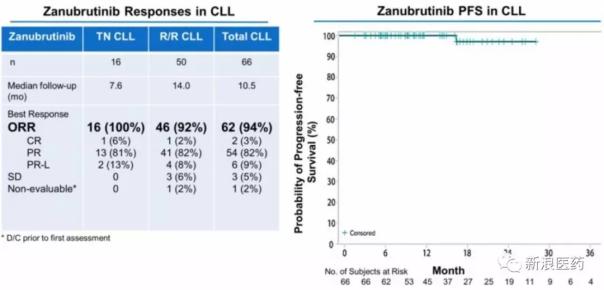
与zanubrutinib相比,人数与ibrutinib的PCYC-1102的IB/2试验相当,但ORR明显提高。虽然zanubrutinib在全球市场会比Acalabrutinib晚一步,但主要是先占领中国市场。
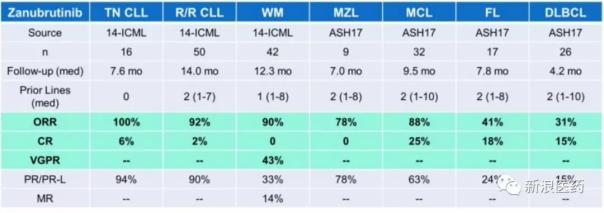
Zanubrutinib治疗各种b细胞淋巴瘤的疗效
值得一提的是,Ibrutinib也在同年被认定为突破性疗法。从一期试验到FDA批准上市大概用了5年时间,希望尽快听到Zanubrutinib的好消息。