2021年10月8日,ChemoCentryx宣布,美国FDA已批准Tavneos(avacopan)上市,这是一种口服选择性补体5a(C5a)受体抑制剂,用于与标准疗法结合,辅助治疗两种主要的抗中性粒细胞胞质自身抗体(ANCA)相关的血管炎:显微血管炎(MPA)和肉芽肿伴血管炎(GPA)。ANCA相关血管炎是一种罕见而严重的自身免疫性肾病,其医疗需求很高。根据新闻稿,这是十年来FDA首次批准ANCA相关血管炎药物,也是FDA批准的第一个口服补体C5a受体抑制剂。
ANCA相关性血管炎是一种由于C5a补体通路过度激活而导致的系统性疾病,C5a补体通路进一步激活中性粒细胞,导致炎症和小血管破坏,可导致器官损伤和衰竭。目前,ANCA相关血管炎的治疗包括非特异性免疫抑制剂(环磷酰胺或利妥昔单抗)联合长期每日糖皮质激素给药,这可能导致显著的临床风险,包括因感染而死亡。
Avacopan能准确阻断中性粒细胞等炎症细胞上的C5a受体,阻止这些细胞被C5a激活,减轻炎症损伤。
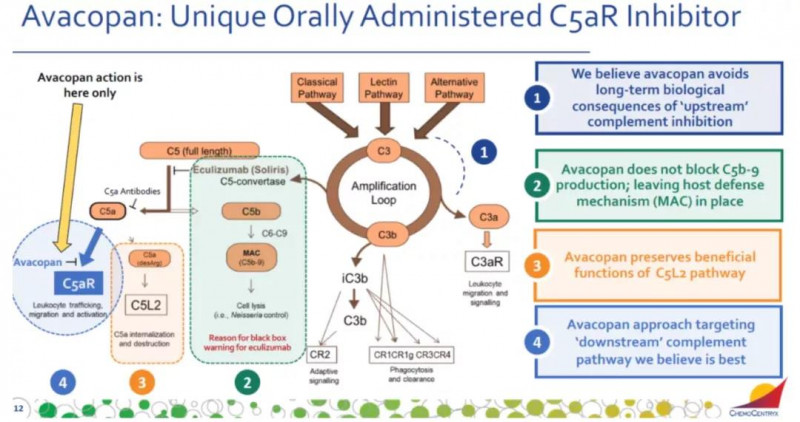
这一批准得到了关键的3期试验的积极结果的支持。来自331例多血管炎和多血管炎肉芽肿患者的数据显示,根据伯明翰血管炎活动评分(BVAS),在治疗的第52周,阿伐可潘组的缓解率优于标准治疗组。
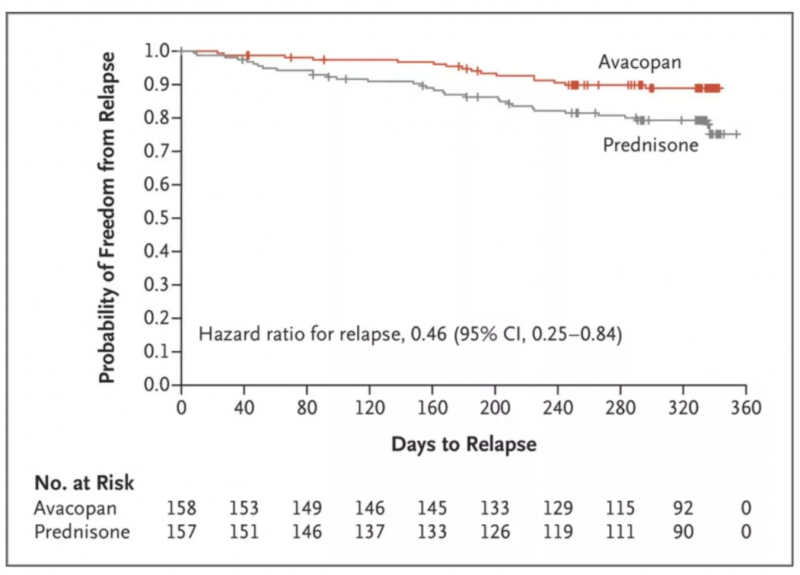
在治疗的第52周,avacopan组的缓解率优于标准治疗组(来源:参考文献[2])
具体而言,在治疗的第52周,阿伐可潘组有65.7%的患者观察到持续缓解,而对照组为54.9%(非劣效性;P=0.007)。
在安全性方面,接受avacopan治疗的患者中有37.3%,接受对照药物治疗的患者中有39.0%出现严重不良事件(不包括血管炎的加重)。
参考资料:
[1] ChemoCentryx宣布FDA批准Tavneos(ava copan)用于ANCA相关性血管炎。检索于2021年10月8日,来自
[2] Avacopan用于治疗ANCA相关血管炎。(2021).新英格兰医学杂志,384(21),e81。
(原文已删除)
关注药明康德微信官方账号
