关键质量参数是单克隆抗体仿制药研发的基准,包括糖基化修饰、聚集性、电荷异质性等。其中,糖基化修饰对单克隆抗体的生物活性、免疫原性、药代动力学、构象、稳定性和溶解性有重要影响。细胞培养的环境,如pH、温度、渗透压、溶解氧等参数都会影响单克隆抗体的糖基化性能。本文对文献中渗透压、培养时间、溶解氧等培养控制参数以及温度、剪切力、培养方式对糖基化影响的研究进行了简要总结。
渗透压和培养时间
通过在基础培养基或补料培养基中添加NaCl可以实现体系渗透压的调节,从而考察渗透压对细胞生长、蛋白质产量和质量的影响。renpacis团队将基础培养基的渗透压分别准备为300、330、360和400 mOsm/kg,补料培养基的渗透压分别准备为750和1250 mOsm/kg,取不同时间段的样本进行测试,然后研究渗透压和培养时间对蛋白质糖基化的影响。实验中使用了CHO细胞。
渗透压为300 mOsm/kg的基础培养基和渗透压为750 mOsm/kg的补料培养基作为对照组。如图1所示,对照组的Man5在第22天为15%,而当基础培养基的渗透压为400 mOsm/kg时,对照组的Man5为18%。在类似的条件下,当饲料的渗透压增加到1250 mOsm/kg时,Man5的比例增加到23-27%。然而G0F的表现却恰恰相反。渗透压升高会导致G0F比值降低,不同渗透压下的G1F差异不显著。在renpacis实验中,随着渗透压的升高,Man5升高,G0F降低,G1F略有波动。研究人员在CHO-B,C,D和e也发现了类似的情况。
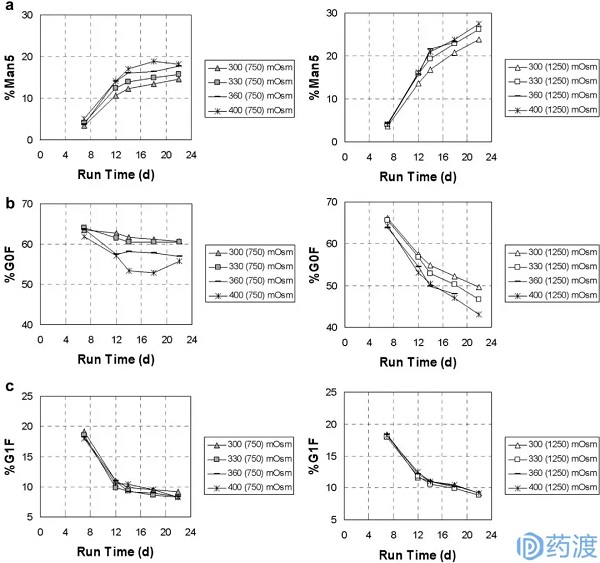
图1不同基础培养基(300、330、360和400 mOsm/kg)和补料培养基(750和1250 mOsm/kg)中的糖基化(a. Man5b. G0FG1F)(来自参考文献1)
另外,从图1中可以看出,随着培养时间的增加,Man5呈上升趋势,而G0F和G1F均呈下降趋势,这可能与蛋白质的一些自发过程有关。而且在高渗透压的情况下,细胞的生长会受到抑制,蛋白质的产量也会下降。因为人细胞表达的高甘露糖糖型(Man5-9)蛋白抗体一般在5%左右,所以通常不采用高渗透压培养条件。
为了解释渗透压影响糖基化的机制,研究人员检测了GnT-1 (N-乙酰氨基葡萄糖转移酶I,它调节Man5和其他糖之间的连接)的mRNA水平。测量来自不同渗透压组D3、7、12和14的样品。结果表明,不同渗透压组GnT-1 mRNA差异不大,渗透压对Man5水平的影响可能是通过影响GnT-1酶活性或mRNA转录实现的。
溶氧(Dissolved Oxygen,DO)
作为细胞培养的一个重要参数,在一般的实验规模或生产规模中通常设定为40%,但也有一些情况。一些学者认为将DO范围设定在25-50%是最佳的细胞培养条件,即使细胞可能缺氧;然而,将溶解氧维持在过高水平会加速过氧化物的形成,损害DNA、蛋白质和脂质,还会导致细胞生长不良。
有时,由于传质效果差或细胞的需氧量高,溶解氧会被设定在较高的水平,如60-80%。先不管这样的参数设置是否真的能解决问题,先了解溶解氧对单克隆抗体糖基化的影响。关于DO对蛋白质糖基化的影响,学者们的研究结果也不一致。例如,一些学者的研究表明,低水平的DO会降低半乳糖的糖基化,而另一些研究指出,DO不会影响半乳糖的糖基化。可见DO对糖基化的影响还与细胞系等因素有关。
VeronicaRestelli等人在2.4/4L培养体系中研究了3、10、50(对照)、100和200% DO对细胞生长、蛋白质产量和糖基化的影响,并利用CHO-K1细胞系合成红细胞生成素(EPO)。
VeronicaRestelli首先用弱阴离子交换柱分离EPO,然后分析蛋白质的唾液酸化程度。测试结果如表1所示。所得样品中的唾液酸化水平基本上为83-93%,平均水平为89%。除了100% DO的16.37%非唾液酸化外,其他水平DO的非唾液酸化基本相同。Veronica Restelli用HPLC检测不同结构类型EPO(复合、杂合、高甘露糖)的糖基化,结果表明DO的不同设定值对其没有影响。
表1 DO对EPO唾液酸化的影响
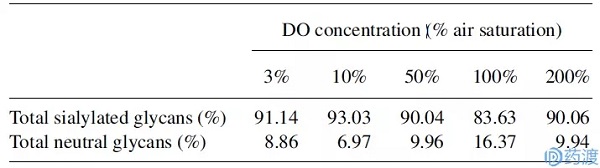
在不同的DO设置(3、10、50、100和200%)下,蛋白质的岩藻糖范围为75-81%。如图2所示,DO为50%或100%时,岩藻糖水平约为80%。当DO为3、10和200%时,蛋白质的平均岩藻糖含量为75-76%。即DO为50%或100%时,岩藻多糖的糖化水平最高,随DO的增加或减少而逐渐降低。总的来说,在Veronica Restelli的实验研究中,EPO的糖基化修饰在较大范围的DO中变化不大,实验所用的细胞系在相似的环境中对DO具有较高的耐受性。
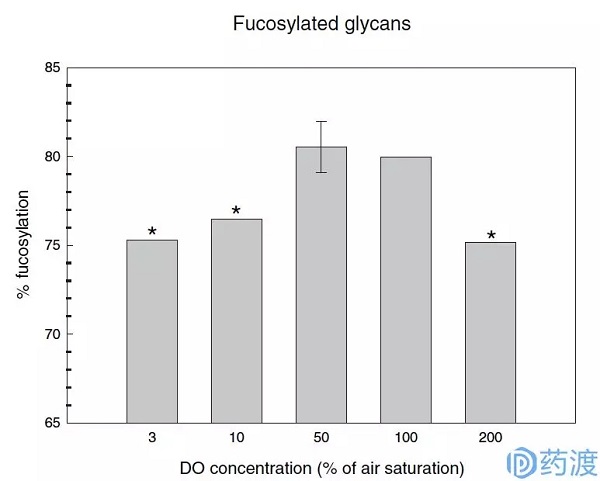
Kunkel等人研究了DO对IgG半乳糖化的影响,并对DO的三个梯度(10,50,100%)进行了实验。结果显示,增加DO浓度可以促进IgG的半乳糖化,如图3所示。当DO为10%时,G2的含量为12%,而当DO为100%时,G2的含量增加到30%。G1的变化并不明显。
DO影响蛋白质糖基化的机制尚不清楚。有学者认为DO降低了细胞内UDP-gal(尿苷二磷酸半乳糖)的利用率,进而进入高尔基体的前体减少。也有人认为,早期含有二硫键的重链化合物会极大地影响半乳糖进程。
温度(Temperature)
生物反应器温度是控制细胞生长和蛋白产量的重要手段,细胞培养的最佳温度(T)一般为37左右。在培养初期,37的培养温度可以获得较高的细胞密度,而当细胞密度接近峰值时,降低温度至30左右是延长对数生长期的常用手段,从而获得较高的蛋白产量。
而变温不仅可以提高蛋白产量,有研究发现低温下细胞内蛋白酶等毒性酶的活性会降低,从而在一定程度上提高蛋白的品质。现就温度漂移对糖基化影响的相关研究做一简要综述。
Michael等人研究了不同变温时间(早期、中期和晚期)对唾液酸含量的影响。如图1所示,冷却时间越晚,细胞的峰值VCD越高,但冷却时间对唾液酸含量的影响几乎可以忽略不计。当在早期(D3)、中期(D4)和后期(D5)调节培养温度时,在第11天收集的样品的唾液酸含量分别为0.98、0.98和0.92。此外,三种不同方案下D10和第12天的唾液酸含量基本相同。
也就是说,在迈克尔的研究体系中,D3、D4和D5调节培养温度对唾液酸没有明显的影响,但会影响细胞的表达。此外,研究人员在没有温度漂移的情况下没有实验控制数据,因此对温度漂移对系统中蛋白质糖基化的影响的研究并不彻底。温度变化对唾液酸总量无明显影响,但对两种形态唾液酸Neu5Gc和Neu5Ac的比重有明显影响。当温度转换时间延迟时,Neu5Gc水平明显下降29-59%,影响了它们之间的相互转化,但对总唾液酸含量没有影响。
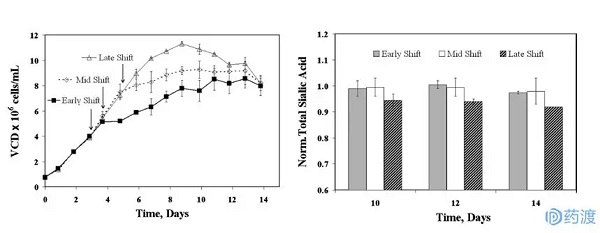
图1不同温度变化时间对细胞生长(左)和蛋白质唾液酸化(右)的影响(图片来自参考文献4)
在Mariela的另一篇文章中,他还研究了CHO-K1-hGM-CSF细胞系在不同培养温度(37和33)下对细胞生长、hGM-CSF产生和糖基化的影响。在实验组中,研究人员将一组实验一直保持在37,而另一组在细胞密度接近峰值时将温度降至33。
发现低温(33)有利于维持细胞活力,33时hGM-CSF的最高产量是37时的6倍。由于培养环境的变化对蛋白质的质量有重要影响,研究人员在两个温度下测量了HGM-CSF的糖基化,纯化了hGM-CSF和脱盐的hGM-CSF,然后确定了其寡糖结构。测试结果如表1所示。没有唾液酸化的hGM-CSF对岩藻聚糖的糖化保持不变(16.014.2,48.750.7%,35.3 35.1%)。而去唾液酸后的寡糖结构在温度调节后无明显变化(18.717.0%,32.033.4%,32.534.0%,16.815.6%),这意味着调节温度对hGM-CSF糖链末端的唾液酸水平无明显影响。即在Mariela的实验研究中,将培养温度从37(细胞生长阶段)降低到33(蛋白表达阶段),可以改善细胞的生长状态,增加hGM-CSF蛋白的产量,同时对hGM-CSF的糖基化作用较弱。
表1 不同温度时hGM-CSF的寡糖结构比较
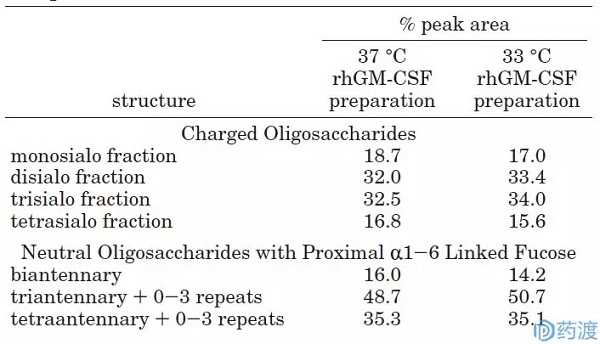
(图表来自参考文献5)
剪切力(Shear stress)
细胞培养中的剪切力可以认为是两层不同流速的培养液之间的摩擦力,细胞在这种“力”的作用下可能会提前死亡或溶解。有报道称剪切力可以影响蛋白质糖基化,但在实验室小规模培养中,剪切力对细胞性能的影响并不明显。随着培养规模的扩大或细胞的敏感性培养,剪切应力成为工艺转移或放大过程中不得不考虑的因素。
搅拌速度的变化会直接影响剪切力。Senger等发现,高剪切力可以使tPA上Asn184位点的糖链长度减少,进而影响蛋白质的糖基化。Senger的研究将tPA的糖基化分为两种类型,型(完全糖基化)和型(部分糖基化)。动力学分析表明,高剪切应力会产生两种结果:tPA蛋白产量增加;型蛋白比例增加,型蛋白比例降低,即蛋白质整体糖基化比例降低。Senger认为高剪切力导致细胞过早死亡或溶解,导致tPA在er中停留时间短(糖基化过程首先发生在ER中,然后在高尔基体中进一步加工)。在糖基化过程完成之前,一些蛋白质被释放到培养环境中,糖基化速率降低。
培养模式
细胞培养模式可分为分批培养、补料分批培养、浓缩补料分批培养、灌注培养等。目前,补料分批培养模式应用最为广泛,灌注连续培养模式也逐渐进入人们的视野。培养模式的改进主要集中在成本控制上,对细胞性能和蛋白质量的影响也是需要考虑的因素。
学者Kunkel等人在研究细胞培养方式(分批、补料分批、灌注)对细胞生长和蛋白质质量的影响时发现,细胞培养方式的改变对蛋白质糖基化表型有明显的影响,他们利用细胞CHO DG44生产SEAP。从整体糖基化率来看,Kunkel发现,与分批和补料分批相比,灌注培养模式产生的蛋白质糖基化率最高,这可能与培养体系中谷氨酰胺的浓度有关。分批和补料分批培养中低浓度的谷氨酰胺限制了糖基化位点。
而对于高甘露糖型,其在分批、补料分批和灌注模式中的比例依次降低,这是由于培养时间不同,细胞存活时间不同(灌注补料分批)。在分批培养中,过早的细胞死亡导致蛋白质从高尔基体中提前释放,但正常的糖基化修饰没有完成。然而,蛋白质SEAP的唾液酸化率是相反的。分批、补料分批和灌注模式下的唾液酸化率分别为17.6%、31.6%和50.9%。作者的解释是,早期细胞死亡或溶解可以释放细胞质中的唾液酸酶,从而降解糖链末端的唾液酸,从而降低唾液酸化率。
参考资料:
1.细胞培养条件对抗体N-连接糖基化的影响——什么影响高甘露糖5糖型
2.溶解氧对中国仓鼠卵巢(Chinese hamster ovary的缩写)细胞生产重组人红细胞生成素及其糖基化的影响
3.优化哺乳动物细胞系统生产的重组蛋白的细胞糖基化代谢
4.培养条件对中国仓鼠卵巢(Chinese hamster ovary的缩写)细胞产生的重组融合蛋白中N-乙醇酰神经氨酸(Neu5Gc)含量的影响
5.表达刺激因子的中国仓鼠卵巢(Chinese hamster ovary的缩写)细胞培养中的降温:对生产率和产品质量的影响
6.哺乳动物细胞培养物中最佳和一致的蛋白质糖基化