11月8日,百时美施贵宝(BMS)宣布,Nivolumab联合化疗作为IIIA非小细胞肺癌(NSCLC)可切除早期IB的新辅助治疗的III期CheckMate-816研究已达到改善无事件生存率(EFS)的主要终点。
此前,CheckMate -816研究的pCR数据和手术结果发表在美国癌症研究协会(AACR)2021年年会和美国临床肿瘤学会(ASCO)2021年年会上。到目前为止,CheckMate-816是第一个针对NSCLC的新辅助免疫治疗的III期试验,以显著提高无事件生存率(EFS)和完全病理反应(pCR)。
第一个吃螃蟹的人,并不好当
有理由相信,随着CheckMate-816数据的成熟,Nivolumab可能在不久的将来获得早期NSCLC的首个免疫治疗方案。在基于IMpower010的atilizumab研究于近日被FDA批准用于早期NSCLC的辅助治疗后,免疫治疗在NSCLC中的应用有望继续向前迈进,为肺癌患者带来更多的长期生存希望。
然而,要成为第一个吃螃蟹的人,并不容易。不禁想起了第一个获批的高危早期三阴性乳腺癌免疫治疗方案的曲折历程。
虽然领域不同,但另一个类似CheckMate-816的随机双盲III期试验是著名的KEYNOTE-522 (NCT03036488)。本研究旨在评价帕博利珠单抗联合化疗在高危早期三阴性乳腺癌(TNBC)患者术前新辅助治疗中的疗效和安全性,并在术后继续单一药物作为辅助治疗。常见的终点是pCR和EFS。从2017年5月开始临床试验,到2021年7月正式获批,历时四年。
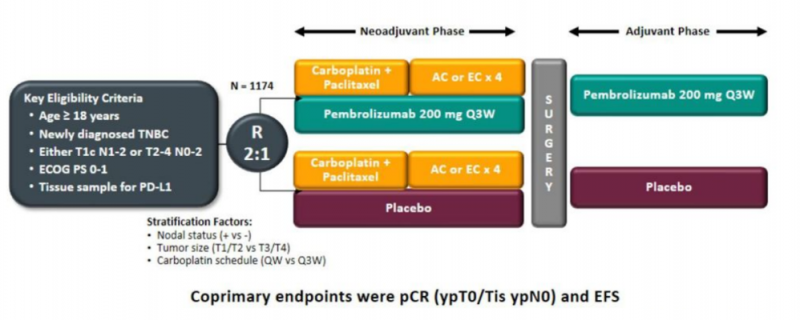
KEYNOTE-522研究设计
早在2019年欧洲医学肿瘤学会(ESMO)会议上,KEYNOTE-522研究的pCR分析数据就已发表,随后发表在《新英格兰医学杂志》上。根据pCR数据和EFS中期研究结果,莫东向FDA提交了Keytruda治疗早期TNBC高危患者的补充生物制剂(sBLA)许可申请。然而,2021年3月,默沙东收到了FDA的完整回复,FDA的肿瘤药物咨询委员会(ODAC)在获得KEYNOTE-522研究的成熟数据后,以10: 0的投票结果决定是否批准这一适应症。
直到今年5月,默克公司宣布KEYNOTE-522研究已经达到EFS的第二个主要终点。两个月后,FDA正式批准pabolizumab联合化疗用于高危早期三阴性乳腺癌的新辅助治疗,术后继续使用pabolizumab作为辅助治疗。
在做出决定之前等待成熟数据的关键因素之一在于对替代终点pCR反映生存益处的普遍怀疑。可以想象,CheckMate-816也要面对这种诘问。
由于历史发展的各种原因,在新辅助治疗的临床研究中有许多替代终点:EFS、pCR、MPR。它们到底是什么意思?它是如何演变的?为什么pCR阳性后还要等EFS结果被监管机构认可?接下来,我们来了解一下。
临床研究也为“KPI指标”而烦恼
为了充分理解各种派生指标,我们需要首先澄清一个问题:什么是新援助?
一般来说,新辅助治疗是术前的抗肿瘤治疗,其次是手术切除。相应的,辅助治疗是指手术后给予的治疗。术前新辅助治疗的主要优势是降低术前肿瘤负荷,清除血液中的肿瘤细胞,达到减少术后复发转移的目的,进而改善患者的预后。此外,新辅助治疗后手术标本的病理缓解率可能成为术后生存的预测指标,可以指导复发高危人群及时进行辅助治疗。
其中,基于死亡事件判断的OS是反映生存获益的“金标准”,非常稳健,不受研究者主观因素的影响,但需要较长的随访时间和较大的样本量。尤其是围手术期治疗,长期生存数据通常需要10年左右才能完成,这不仅成倍增加了研究成本,也使得交叉和后线治疗的影响不可估量。
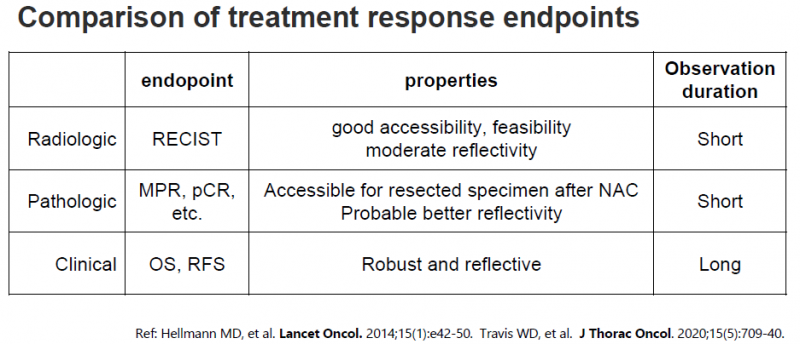
因此,对于治疗反应的评价,通常采用基于影像学的实体瘤疗效临床评价标准(RECIST)来判断疾病进展,如单臂临床试验中常用的客观反应率(ORR)。另一个众所周知的无进展生存期(PFS)结合了影像学评估和临床评估,定义为从随机分组到出现客观肿瘤进展或全因死亡的时间。这是随机对照临床试验中最常用的替代终点。
与PFS(无进展生存期)类似,还有DFS(无病生存期)和EFS(无事件生存期)。三者首字母与单词的区别对应不同疾病阶段的主要治疗目标(KPI):3354转移性疾病“无进展”(不继续发展延长生存时间)、术后辅助/新辅助治疗“无进展”
换句话说,EFS和PFS最大的区别是PFS观察疾病进展/死亡事件;EFS观察了疾病的复发/死亡,还包括了新佐剂的独特终点事件:疾病进展未能起作用。
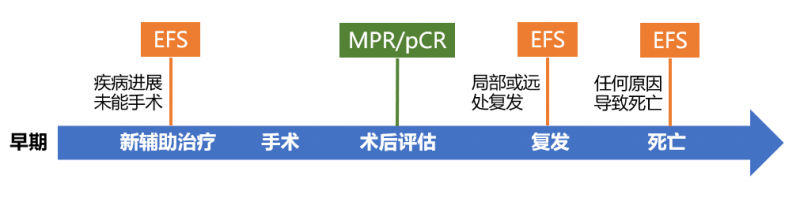
但对于新辅助免疫治疗,由于影像学上存在“伪进展”现象(注:RECIST评分部分病例为进展或稳定,部分甚至完全缓解由病理评估),近年来越来越重视病理评估(pCR、MPR)。

病理完全缓解(pCR)到底是什么?
顾名思义,假定早期肿瘤患者在手术前接受新辅助治疗后出现所谓的“治愈”。pCR被定义为在已经被清除的原发性肿瘤或淋巴结中没有残留的存活肿瘤细胞。
但是,又发现了新的问题。NSCLC新辅助化疗的pCR极低,可能不适合作为替代指标。然后在2014年,Matthew Hellman教授提出了一个全新的——大病理缓解(MPR)的指标,定义为术后标本病理检查残留肿瘤细胞<10%。但是MPR只关注原发病灶,不关注淋巴结,需要更多的数据来证明临界值。也有专家质疑MPR的判断容易受主观因素影响。相比之下,pCR可能是一个更可靠的终点,具有更大的室间一致性。
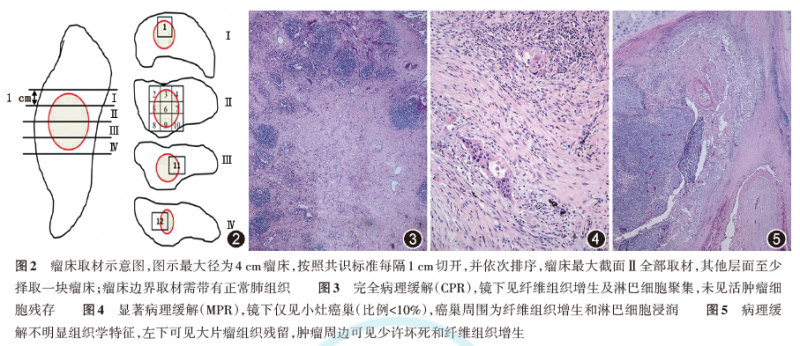
理想很丰满,现实却很骨感。对于非小细胞肺癌新辅助治疗后的手术标本,目前缺乏完整可行的从大体到微观的评估方法。2020年5月,国际肺癌研究协会(IASLC)发布的《新辅助治疗后肺癌手术标本病理评估》多学科推荐方法成为重要参考标准。今年9月,国家癌症质控中心肺癌质控专家委员会发布的《非小细胞肺癌新辅助治疗疗效病理评估专家共识》也标志着国内病理反应评价体系的进一步完善。
根据共识,在合理识别瘤床(注:瘤床是指治疗前原发肿瘤所在的部位,新辅助治疗后可能难以识别瘤床)、标本固定、标准化取样后,可确定完全病理缓解(pCR)或显著病理缓解(MPR)。共识建议将10%作为MPR的临界值,并指出与普通标本相比,新辅助病理标本的评价过程较为复杂,准确性和一致性有待进一步提高。
目前,对于早期高危乳腺癌,EFS和pCR已被FDA作为加速审批的替代终点,仍存在诸多争议和质疑。在肺癌领域,EFS、pCR、MPR尚未写入监管机构的指导性文件。哪个指数更好还是未知数。
回到之前的问题,无论是CheckMate-816还是KEYNOTE-522研究,为什么pCR阳性后还要等EFS结果?或许可以理解为,病理评估过程复杂,易受主观因素影响,其稳健性、可重复性、室间一致性以及与长期效益的关系仍存在诸多不确定性。目前,综合评价pCR和EFS这两个常见主要终点的益处,更容易被监管机构所接受。
挑战标准新辅助化疗,还有几道坎?
目前,免疫疗法已逐渐成熟
人们对此充满期待,因为从机制上来说,PD-1/PD-L1抑制剂需要肿瘤细胞提呈抗原才能杀死肿瘤,而当肿瘤体积较大时,抗原提呈细胞承受的抗原负荷更大,从而表现出更强的抗肿瘤T细胞反应。因此,新辅助免疫疗法在理论上优于辅助免疫疗法,患者可以获得更大的生存获益。几项临床前研究的发现也证实了上述观点。
毫无疑问,任何一种治疗方法都想从晚期走向早期,目的是成为标准治疗。那么,围手术期IO想要挑战标准治疗还有多少坎呢?
1.安全性:新辅助免疫治疗后的手术安全性是外科医生关注的焦点,但没有客观的评价指标。根据现有资料,新辅助免疫单药和联合化疗并未导致大量延期手术。总体平均手术切除率为88.70%,没有增加手术难度和围手术期风险。手术并发症的平均发生率为20.6%,大部分预后良好。基本上,死亡与药物治疗无关。
目前在小样本研究中似乎安全性基本令人满意,但免疫相关肺炎、心脏毒性、消化道毒性等罕见但严重的毒性仍值得临床医生高度重视。对此,今年3月发表在《中国肺癌杂志》上的《非小细胞肺癌围手术期免疫治疗相关不良反应管理的临床诊疗建议》进行了较为详细的阐述。
2.有效性:纵观目前已达到主要研究终点的新辅助治疗研究,总的趋势是IO单药或IO联合化疗,而免疫两药联合表现不佳。
免疫单一疗法的新辅助研究,如MATE159、LCMC3、PRINCEPS、TOPlS01、IoNESCO和ChicTR-OIC-17013726,被纳入I -IIIb期NSCLC患者,在一到三个治疗周期后,MPR在14%到45%之间。Ib -IIIa期患者入选联合化疗新辅助研究(NADIM,NCT02716038,SAKK 16/14),治疗2 ~4个周期。NADIM研究的MPR率高达85.36%,pCR率为71.4%,其他两项研究的MPR约为60%。双重新辅助研究(NEOSTAR)包括I -IIIa期肺癌患者,治疗3个周期,MPR率为24%。CheckMate 816是目前第一个达到主要终点的III期研究,我们期待更多详细数据的发表。
3.病理评估终点和长期获益之间的相关性:随着更多的试验使用MPR和pCR作为新辅助治疗临床获益的替代指标,迫切需要清楚地证明这些病理评估终点反映生存获益的程度。
一项回顾性分析显示,新辅助化疗后获得MPR的患者的DFS和OS明显长于未获得MPR的患者。那么,这种效果适用于免疫联合治疗吗?目前,大多数证据来自II期研究的事后分析。
在NADIM研究(Nivolumab化疗)的后分析中,获得MPR或pCR的患者的24个月OS率为100%,而病理反应不完全的患者的OS率为85.7%(P=0.002)。在另一项新的辅助免疫治疗(atilizumab化疗)临床试验中,事后分析显示,有MPR和无MPR患者的中位DFS分别为34.5个月和14.3个月(P=0.71)。pCR、MPR与OS的关系仍需大量临床资料验证,MPR的定义需要更细致的探索和规范。
小结
还是有一些想法的。如何看待早期患者如此高的病理缓解率?接受新辅助IO后达到pCR可以“避免”手术吗?在联合化疗的疗程设计方面,是同时联合化疗,还是同疗程后免疫治疗,还是几个疗程后序贯免疫治疗?应该减少剂量还是维持常规剂量?新辅助治疗与手术间隔多长时间,并发症最低?临床上应该如何选择患者?有正向驱动基因的患者需要选择吗?如何根据生物标志物筛选真正受益的人?
今年1月,《非小细胞肺癌新辅助免疫治疗国际专家共识》发表在《转化型肺癌研究》(《肺癌转化研究》)杂志上。40多名专家就9种临床治疗方案达成一致。但是临床上还是有太多的争议和未知。在…里
相对于晚期肿瘤,围手术期治疗的研究时间跨度长,治疗期间变化大,往往“十年磨一剑”。在漫长的研究期间,许多因素如治疗药物、治疗策略、人群分布等。可能有较大变化,影响研究进度和结果。只有“耐得住寂寞”,才能做“忠实的妻子”。
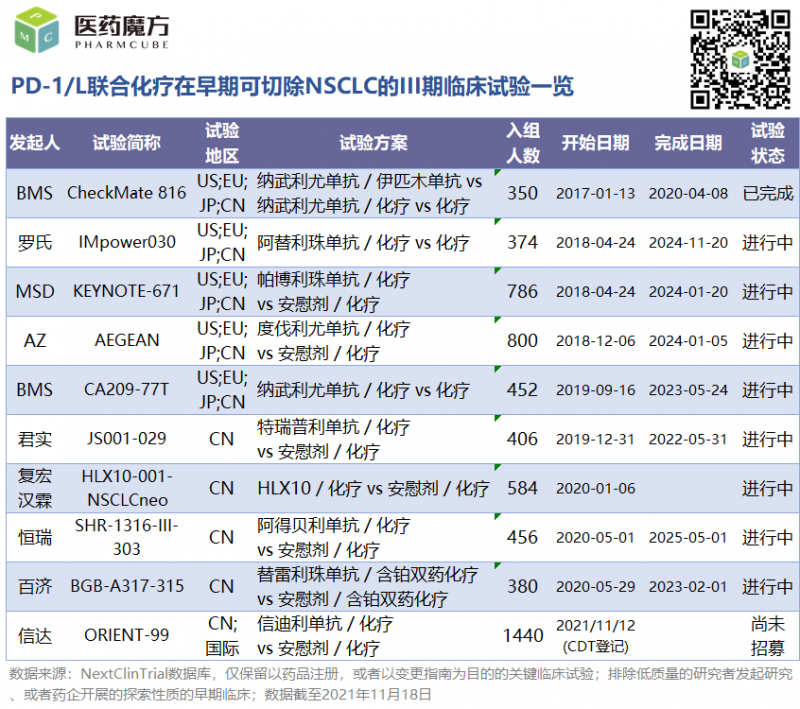
继CheckMate816、IMpower030、KEYNOTE-671的研究之后,君实、百济、恒瑞、傅宏翰林等国内企业也开始布局。信达近期开展了辛地利珠单抗联合化疗用于非小细胞肺癌术前新辅助和术后辅助治疗的国际多中心III期研究(国内640人,全球800人)。我们有信心,这些临床试验将带来更丰富的结果,解决围手术期免疫治疗的许多突出问题。
参考资料:
1.MPR和pCR作为新辅助WCLC治疗的主要终点:(教育会议)
2.病理学完全缓解作为肺癌新辅助治疗后的替代终点。柳叶刀肿瘤。2021年8月;22(8):1056-1058.
3.Neo是什么?可切除非小细胞肺癌的新辅助化疗。临床9月10日;39(26):2855-2858.
4.新辅助治疗后肺癌切除标本病理评估的IASLC多学科建议。胸腔肿瘤学杂志。2020年5月;15(5):709-740.
5.非小细胞肺癌新辅助治疗病理学评价专家共识[J].中华病理学杂志,2021,50(09):1002-1007。
6.非小细胞肺癌围手术期免疫治疗相关不良反应的临床诊治建议[J].中国肺癌杂志,2021,24(3):20。
7.2019中国肺癌高峰论坛访谈[J]。循证医学,2019,(04):14-23。
8.非小细胞肺癌新辅助免疫治疗专家共识。肺癌研究第2020号决议;9(6):2696-2715.
9.中国非小细胞肺癌免疫抑制治疗专家共识(2020年版)[J].中国肺癌杂志,2021,24(4):19。
10.
