
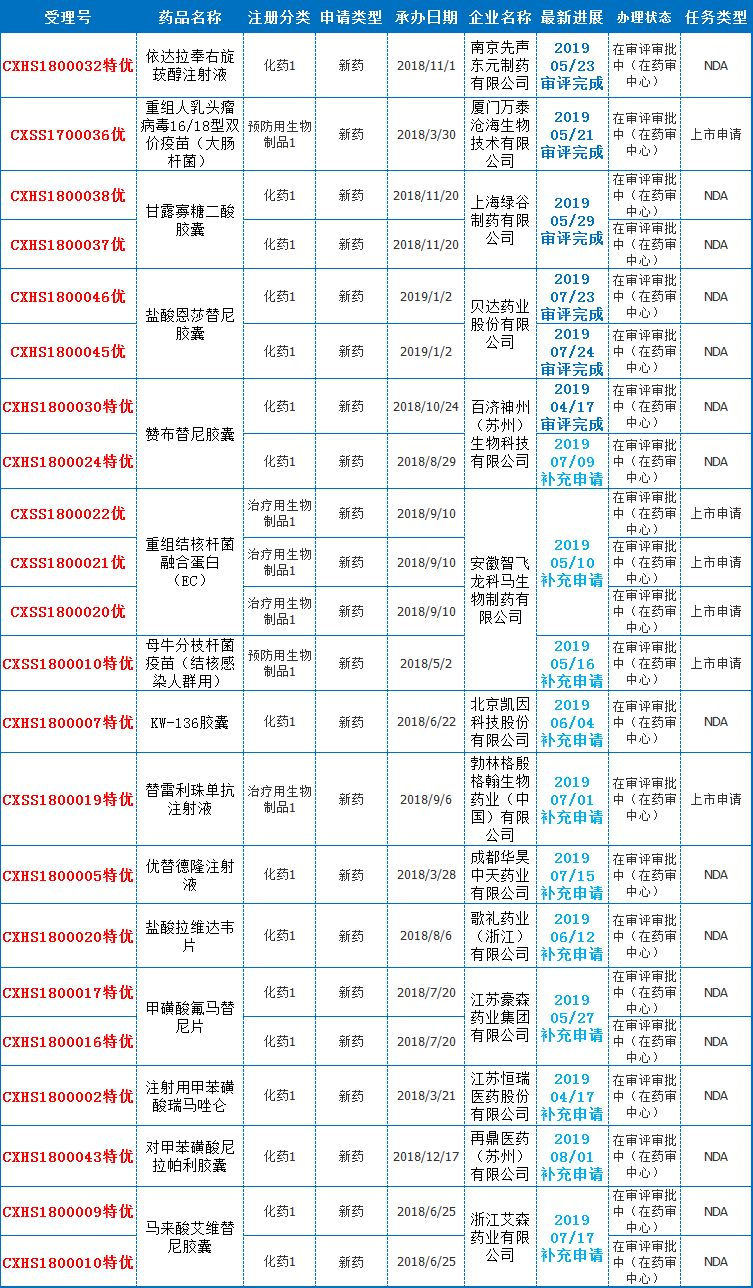
2019年1-7月,合计同意国产1类新药达6个种类,此中3个为医治用生物制品1类新药,离别为:成都康弘生物科技有限公司的[康柏西普眼用注射液]、疑达生物制药(姑苏)有限公司的[信迪利单抗注射液]、姑苏盛迪亚生物医药有限公司的[注射用卡瑞利珠单抗]。3个为化药1类新药离别为:上海同联制药有限公司的[可利霉素片]、江苏豪森药业集团有限公司的[聚乙二醇洛塞那肽注射液]、广东中昊药业有限公司的[苯烯莫德乳膏]。此外借同意1个入口1类新药,为辉瑞制药有限公司的Dacomitinib片。
比拟2018年整年获批了9款1类新药,本年无望再次赶超,获批数目达新高。那么正在后续5个月中,将有哪些1类新药无望取得同意,据药智数据及优先审评药品存在的劣势,挑选出现阶段处于审评审批中的优先审评1类新药,曾经实现增补请求进入审评顺序,或曾经实现审评顺序将进入审批顺序的药品。且看下表:
1.审评审批新静态
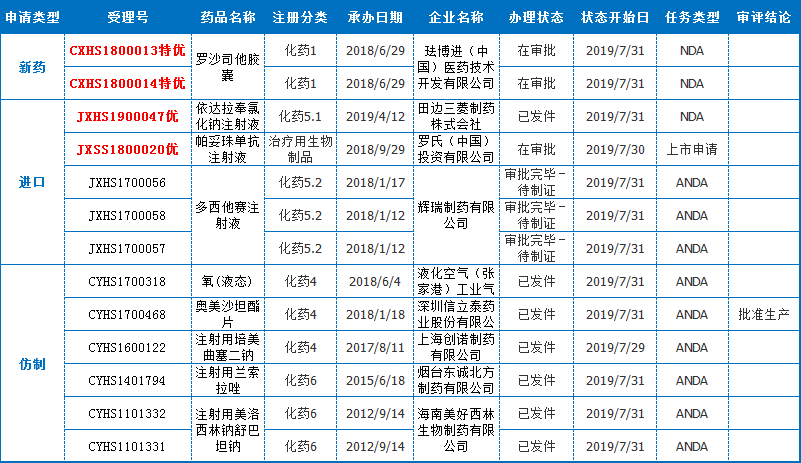
本周(7月26驲-8月2驲)有13个报出产的药品受理号解决形态更新,此中珐博进(中国)医药技术开发有限公司的1类新药[罗沙司他胶囊]、罗氏(中国)投资有限公司的入口单抗[帕妥珠单抗注射液]进入“正在审批”顺序,值得存眷。
珐博进(中国)[罗沙司他胶囊]
2018年12月,珐博进(中国)医药技术开发有限公司的国产1类翻新药罗沙司他(商品名:爱瑞卓)获批上市。罗沙司他是寰球首个口服低氧引诱因子脯氨酰羟化酶抑制剂(HIF-PHI)是史上初次由中国起首同意全新作用机制的国际初创原研药上市,实现三“尾”的翻新冲破,存在里程碑意思,意味着我国药品审评审批才能曾经具有国际水准。该药获批用于慢性肾脏病(CKD)透析患者血虚的医治,包罗血液透析跟腹膜透析患者。
同年6月,珐博进(中国)再申报2个受理号,且正在2018年8月9日以“与现有医治手腕比拟存在较着医治劣势”归入优先审评顺序药品注册请求第三十一批。本年7月尾进入“正在审批”顺序,或将取得同意上市,增长药品市场劣势。
罗沙司他由珐博进(中国)跟阿斯利康协作研发。珐博进(中国)担任展开罗沙司他正在海内的临床试验跟药品注册申报,并持有国家药监局核发的悉数注册批件。获批上市后,珐博进担任罗沙司他的出产经管跟医学事件,阿斯利康担任罗沙司他正在中国的商业化举止。
罗氏(中国)[帕妥珠单抗注射液]
[帕妥珠单抗注射液]初次由上海罗氏申报,于2018年12月获CDE同意入口。结合曲妥珠单抗跟化疗用于存在下复发危险的人表皮生长因子受体2(HER2)阳性初期乳腺癌患者的帮助医治。该药正在上市后,于2019年正在海南中标,规格420mg(14ml)/瓶中标价为18800元。而现进入“正在审批”顺序的受理号于2018年9月获CDE受理,于11月以“存在较着医治劣势翻新药”为由归入优先审评。
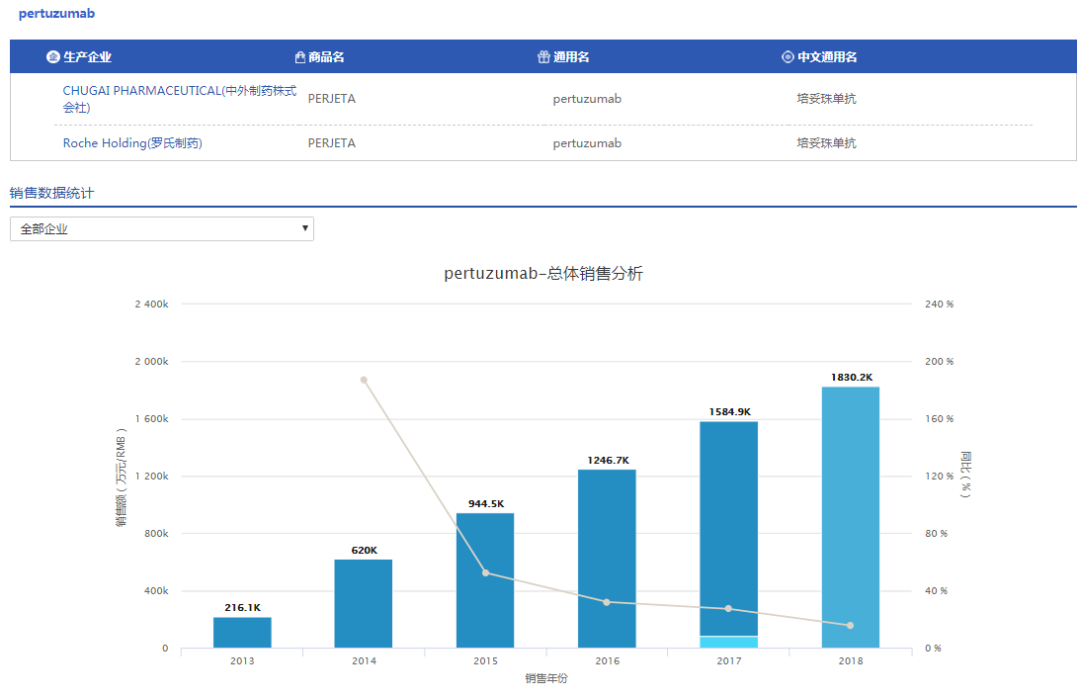
Pertuzumab是一种表皮生长因子受体2卵白(HER2)拮抗剂,其靶向于HER2,经由过程抑止HER2及其它HER家族成员之间的配体依赖性同二聚化作用,阻断细胞周期并引诱凋亡。
帕妥珠单抗(Pertuzumab)由基因泰克(罗氏的子公司)研发,于2012年6月8驲取得美国食品药品管理局(FDA)同意,2013年3月4驲取得欧洲药物管理局(EMA)同意,2013年6月28驲取得日本医药品医疗器械综合机构(PMDA)同意上市,并由罗氏(美国的基因泰克,日本的中外制药)正在美国、欧洲跟日本市场发卖,商品名为Perjeta。自上市以来销售额稳步增长,2018年翻新下,达2773百万瑞士法郎,折合人民币183.02亿元。
信立泰药业[奥美沙坦酯片]
7月31驲,深圳信立泰药业股分有限公司的[奥美沙坦酯片]取得同意出产,商标名为“信达悦”。奥美沙坦酯为血管重要素II受体拮抗剂类抗高血压药物,其半衰期较长,存在服用便利、服用剂量小、起效快等特色,为《国度根本医疗保险、工伤保险跟生养保险药品目次(2017年版)》医保乙类产物,被《中国高血压防治指南》(2018年修订版)、《高血压公道用药指南》列为常用降压药物。
奥美沙坦酯片原研厂家为日本第一三共股份有限公司,2006年,第一三共制药(上海)有限公司出产的奥美沙坦酯片正在海内上市。信立泰为海内第3家依照一致性评估的要求实现生物等效性实验,经由过程(或视同经由过程)一致性评估。此外2家为南京正大晴和制药、广东东阳光药业有限公司。
2.审评审批新受理
本周报出产药品取得CDE承办的受理号达49个,此中4个为进口药,其余均为仿造药。
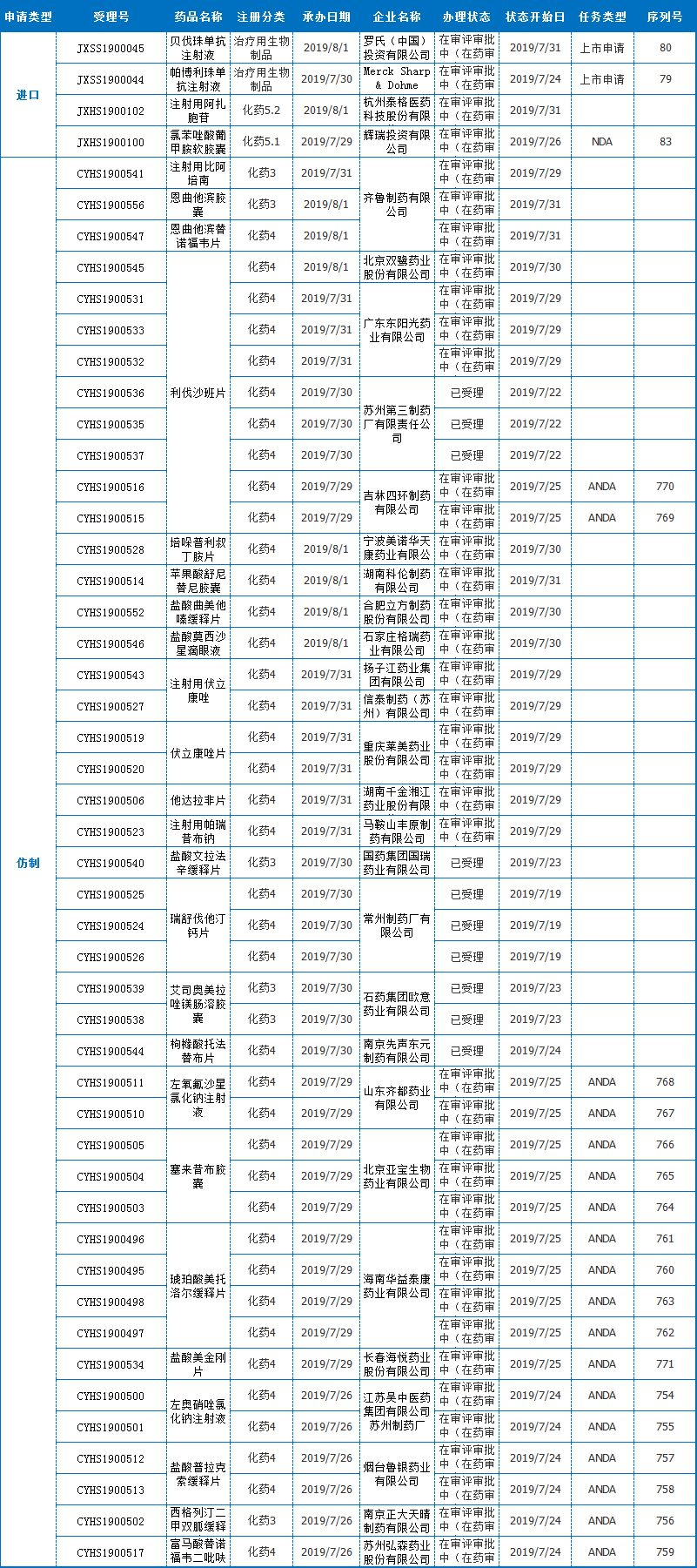
辉瑞投资[氯苯唑酸葡甲胺软胶囊]
7月29驲,辉瑞投资的[氯苯唑酸葡甲胺软胶囊]入口请求取得受理。VYNDAQEL(氯苯唑酸葡甲胺,tafamidismeglumine)是口服转甲状腺素卵白稳定剂,可能选择性天与转甲状腺素卵白联合,不变转甲状腺素卵白的四聚体,减缓招致ATTR-CM的淀粉样物资的造成。
VYNDAQEL于2012年正在欧盟跟美国取得了医治ATTR-CM的孤儿药认定,于2018年正在日本取得孤儿药认定。2017年6月跟2018年5月,美国FDA前后授予了VYNDAQEL快捷审评资历,并认定ATTR-CM为突破性疗法。2018年11月,美国FDA同意了VYNDAQEL新药请求(NDA)的优先审评资历。
2019年3月,日本厚生休息省同意授予VYNDAQEL以SAKIGAKE(当先型,前驱型)药物名称,用于医治野生型跟变异型ATTR-CM患者。对于ATTR-CM患者利用VYNDAQEL的注册请求已递交给欧洲药品管理局(EMA)。
VYNDAQEL于2011年初次正在欧盟取得同意医治转甲状腺素卵白淀粉样变多发神经病(ATTR-PN),用于初期症状性多发神经病的成年患者以延缓周围神经毁伤。ATTR-PN是淀粉样变性的一种神经系统退行性疾病,可招致下肢感到缺失、痛苦悲伤跟有力、和自立神经系统的损伤。已正在40个国度获批医治ATTR-PN,此中包罗日本、一些欧洲国度、巴西、墨西哥、阿根廷、以色列、俄罗斯跟韩国。
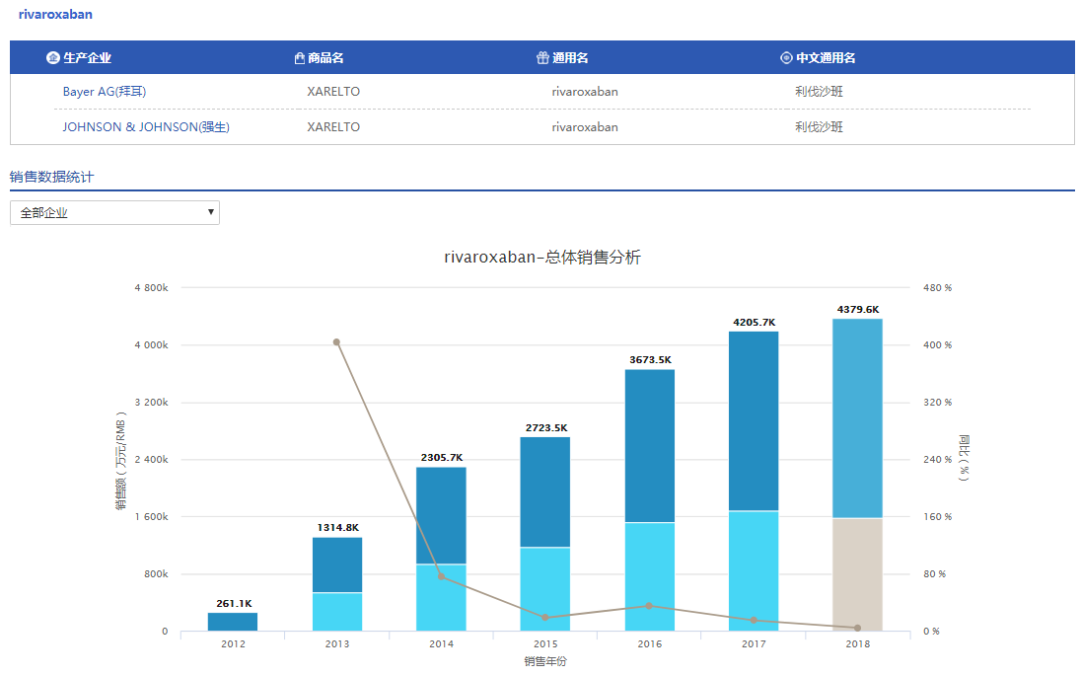
4企业[利伐沙班片]
本周内北京双鹭药业股分有限公司、广东东阳光药业有限公司、姑苏第三制药厂有限责任公司、吉林四环制药有限公司4公司均有申报利伐沙班片仿造药上市,且均取得受理。至此,利伐沙班片依照新4类仿造申报的受理号达33个,波及20家企业,竞争剧烈,利伐沙班化合物专利于2020年到期。
现阶段希望较快的为正大晴和药业集团,于7月23驲进入“正在审批”形态。而此前5月27驲,姑苏第三制药厂的[利伐沙班片]显现“已发件”,但终极已收到获批的动静,正大晴和无望赶超。
利伐沙班是一种选择性凝血因子Xa抑制剂,由拜耳(Bayer)跟杨森(Janssen)联合开发,于2008年9月30日获欧洲药物管理局(EMA)同意上市,2011年7月1日获FDA同意正在美国上市,2009年6月,拜耳出产的利伐沙班进入中国(商品名:拜瑞妥),用于成人择期齐髋或齐膝关节置换术后静脉血栓的防备。2015年5月,利伐沙班片的两个新适应症又取得CFDA同意,离别为治疗跟防备深静脉血栓组成并防备肺栓塞,跟房颤患者的卒中防备。利伐沙班自上市发卖始终看涨,2018年销售额折合人民币达437.96亿。
湖南科伦[苹果酸舒尼替僧胶囊]
8月1驲,湖南科伦制药有限公司的[苹果酸舒尼替僧胶囊]仿造药上市请求取得受理。苹果酸舒尼替僧由辉瑞(Pfizer)研发并出产,起首于2006年1月26日获美国食品药品管理局(FDA)同意上市,之后于2006年7月19日获欧洲药物管理局(EMA)同意上市,于2008年4月16日获日本医药品医疗器械综合机构(PMDA)同意上市,由辉瑞上市发卖,商品名为Sutent。
舒尼替僧是小份子多靶点受体酪氨酸激酶(RTKs)抑制剂,存在抑止肿瘤血管天生跟抗肿瘤细胞发展跟转移的多重作用。该药用于医治胃肠道间质瘤(GIST)晚期肾细胞癌(RCC)跟胰腺神经内分泌肿瘤(pNET)。
现阶段海内仅有进口药,仿造药报产受理号达20个,此中10个为旧6类申请号,现阶段均已获批临床;8个为新4类请求受理号,波及石药欧意、正大晴和、江苏豪森、齐鲁制药(海南)和本次的湖南科伦,5家实力企业开抢,首仿花落谁家,敬请期待。