11月1日,国家食品药品监督管理总局药品审评中心(简称“CDE”)发布《第一批临床急需境外新药名单的通知》称,国家药品监督管理局、国家卫生健康委员会制定了《临床急需境外新药审评审批工作程序》,并按程序组织专家遴选出48个临床急需境外新药,该名单前期已在我中心网站公示。其中,8个品种已在近期获批上市,现将其他40个品种名单按程序对外公布。

《通知》称,列入临床急需境外新药名单的品种,可按照《临床急需境外新药审评审批工作程序》提交相关资料,直接提出上市申请,CDE建立专门通道加快审评。尚未申报的品种,可随时提出与CDE进行沟通交流,尽快提出上市申请。
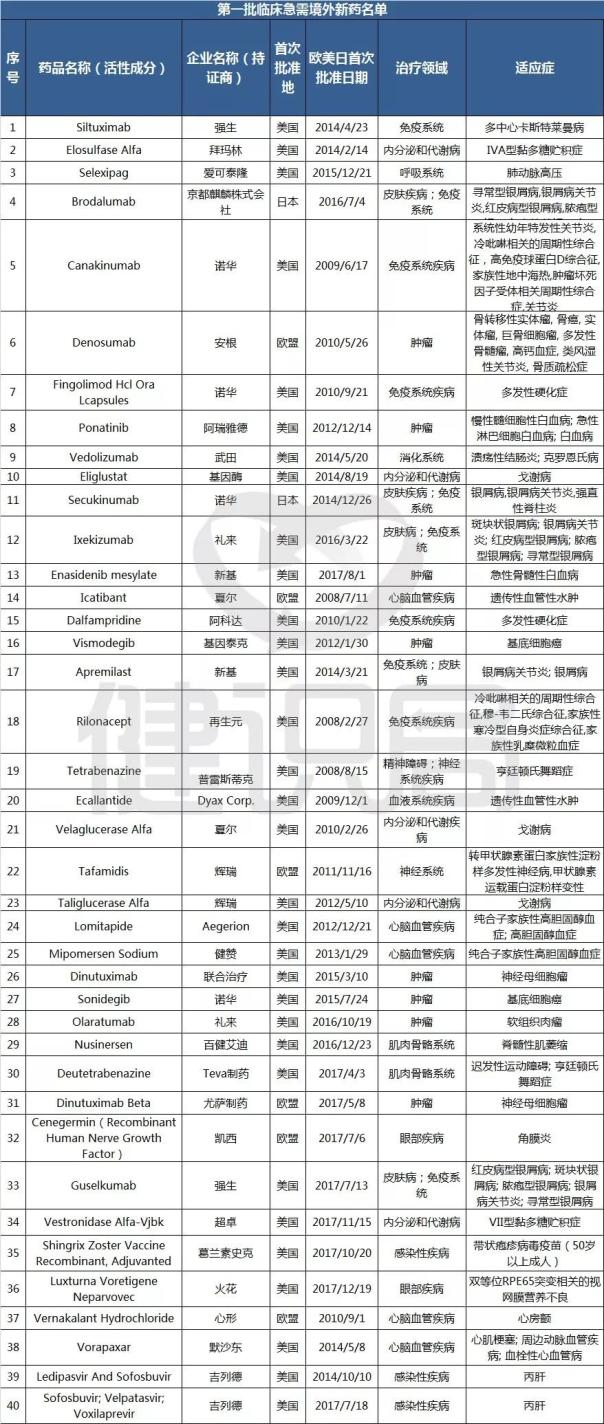
纵观这40个全球重磅品种,大多都是罕见病、临床急需的特效药。其中包括:吉列德公司的两款丙肝新药、诺华治疗银屑病的Secukinumab、礼来治疗软组织肉瘤的Olaratumab等。
事实上,纳入境外已上市临床急需新药名单的药品,尚未进行申报的或正在我国开展临床试验的,经申请人研究认为不存在人种差异的,均可提交或补交境外取得的全部研究资料和不存在人种差异的支持性材料,直接提出上市申请,国家药品监督管理局将按照优先审评审批程序,加快审评审批。
有分析人士指出,承认境外临床数据,意味着新药在中国注册可省下在国内做临床试验的时间,大大缩短了境外新药在华上市的周期。同时也有利于国内药企走向海外,开展境外临床试验。
此前,九价宫颈癌疫苗、丙肝新药索磷布韦、肿瘤PD-1免疫治疗药物(Opdivo、Keytruda)等多个防治严重危及生命疾病的境外新药,已在国内集中上市。业界普遍认为,这得益于国家一系列加快境外药品审评审批政策的出台。同时,国家医保谈判工作也在不断推进,也增加了患者的用药的可及性。