文丨张红利
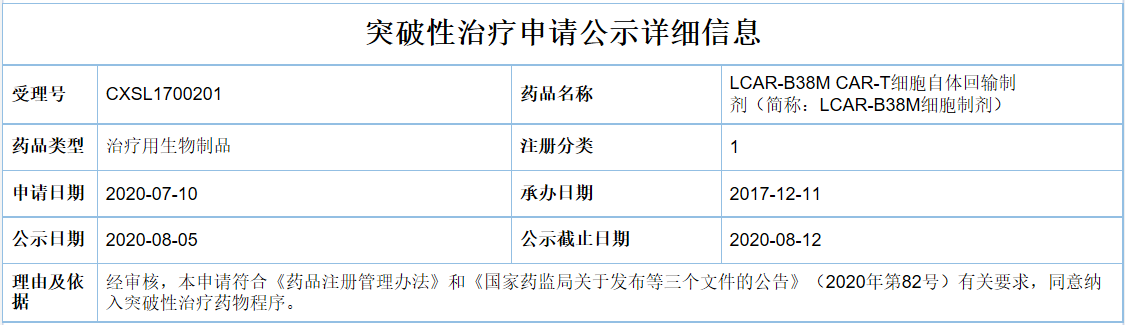
8月5日,CDE官网公示了首个拟突破性治疗品种,为南京传奇生物的LCAR-B38M CAR-T细胞自体回输制剂(简称:LCAR-B38M细胞制剂)。

值得注意的是,这是自7月8日国家药监局发布《突破性治疗药物审评工作程序(试行)》以来,“突破性治疗公示”栏的首次更新。根据公示信息,传奇生物是在7月10日提交的该疗法突破性疗法认定的申请。
LCAR-B38M是由传奇生物开发的一款靶向B细胞成熟抗原(BCMA)的CAR-T疗法,该疗法结构新颖,含有4-1BB共刺激结构域和两个BCMA靶向单域抗体,用于接受过既往包括蛋白酶体抑制剂,免疫调节剂和抗CD38抗体的治疗方案和在末次治疗期间或之后出现疾病进展的复发或难治性多发性骨髓瘤成年患者。
2017年6月,LCAR-B38M在ASCO年会中凭借100%的客观缓解率惊艳全场。同年12月,传奇生物与强生旗下杨森签订了一项全球合作和许可协议,共同开发和商业化LCAR-B38M/JNJ-4828。杨森向南京传奇生物支付3.5亿美元首期款及后续里程碑付款,创下了当时中国药企对外专利授权首付款最大金额记录及合作最优条件。

接下来的两年,LCAR-B38M进展顺利,硕果累累。2018年,先后获得中国首个CAR-T临床试验申请批件、美国FDA的IND批准;2019年,获得FDA授予的孤儿药资格和突破性疗法认定,以及欧洲药品管理局授予的优先药物资格(PRIME)。
2019年12月,在第61届美国血液学会(ASH)年会上,两家公司首次公布了LCAR-B38M有效性及安全性的Ib/II期CARTITUTE-1研究的最新临床数据。结果表明,LCAR-B38M在治疗29名复发或难治性多发性骨髓瘤(R/R MM)患者中表现出优异的疗效,在中位随访时间为6个月时,达到100%的总缓解率(ORR)。其中69%的患者达到完全缓解或更好缓解、86%的患者达到非常好的部分缓解或更好缓解。
在今年ASCO年会上,两家公司更新了LCAR-B38M试验的数据:在中位随访时间为11.5个月时,所有患者对治疗有反应,并且为持久的深度反应。其中,ORR保持100%,86%的患者达到了严格的完全缓解,9个月无进展生存率为86%。
优异的临床数据,让LCAR-B38M成为CAR-T市场强有力的竞争者。传奇生物招股书透露,两家公司将于今年底前在美国提交LCAR-B38M的上市申请,于2021年在中国提交上市申请。此次该药拟纳入突破性疗法,将进一步加速中国上市进程。
公开资料显示,目前还有两家药企提交了突破性疗法申请:7月17日,李氏大药厂递交PD-L1单抗ZKAB001宫颈癌适应症突破性疗法申请;7月23日,再极医药申请FLT3/FGFR双靶点抑制剂MAX-40279治疗FLT3野生型急髓性白血病突破性疗法标签。