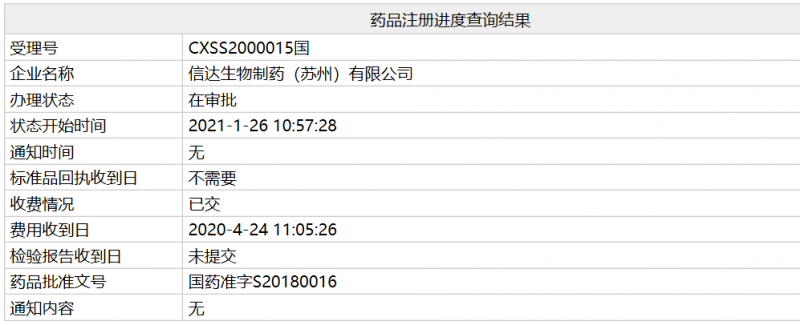
1月27日,官网国家美国食品药品监督管理局显示,信达生物indilizumab上市第二适应症(受理号:CXSS2000015)申请处于“审批中”阶段,有望于近期获得NMPA的批准。培美曲塞铂一线治疗非鳞状非小细胞肺癌的适应症。
一项代号为ORIENT-11的随机、双盲、安慰剂对照III期研究评估了辛地利珠单抗或安慰剂联合培美曲塞二钠和铂作为晚期或复发性非鳞状非小细胞肺癌(nsqNSCLC)的一线治疗的有效性和安全性。
本研究共有397名受试者,按照2:1的比例随机分为两组。他们每三周接受一次cindilizumab 200mg或安慰剂联合培美曲塞二钠和铂的治疗。经过四个周期的治疗后,他们接受了cindilizumab或安慰剂联合培美曲塞二钠的治疗,直到疾病进展、毒性不耐受或其他需要停止治疗的情况。
中期分析结果显示,辛地利珠单抗联合培美曲塞二钠和铂组与安慰剂联合培美曲塞二钠和铂组相比,显著延长了患者的无进展生存期(PFS ),达到了预设的疗效标准。安全性特征与之前报告的sindilizumab结果一致,没有新的安全性信号。
地利珠单抗注射液是中国信达生物和礼来公司共同研发的PD-1抑制剂。2018年12月,它首次被NMPA批准用于治疗至少二线全身化疗后复发或难治的经典型霍奇金淋巴瘤。1月13日,信达提交了信达利珠单抗第5个适应症的上市申请。
地利珠单抗已于2020年进入医保,价格为2843元(10ml:100mg/瓶),仅限于至少接受过二线全身化疗的复发或难治性经典型霍奇金淋巴瘤患者。
肺癌是我国发病率和死亡率最高的恶性肿瘤。中国约70%的非小细胞肺癌患者是非鳞状细胞肺癌,其中近50%没有EGFR敏感突变或ALK基因重排。这些晚期肺癌患者不适合靶向治疗,治疗手段有限,巨大的医疗需求未得到满足。
