满语
检查点阻断疗法是抗癌领域的重要进展。代表药物PD-1/PD-L1抗体极大地改善了许多人类癌症的临床结果。然而,癌症免疫治疗仍有一些问题需要解决,包括为什么只有少数患者可以对PD-1/PD-L1抗体产生反应,以及为什么一些患者不能获得长期的治疗效果。为了找到这些问题的答案,科学家们正在深入了解调节免疫检查点通路的机制。
PD-L1主要定义为PD-1的配体,PD-L1和PD-1的结合可以抑制效应T细胞的反应。当癌症发生时,PD-L1通常在肿瘤细胞中高表达,导致免疫逃逸。除了最初发现的这种功能,PD-L1还被报道为抗凋亡分子,并且可以促进哺乳动物雷帕霉素靶蛋白(mTOR)的活化和肿瘤细胞中的糖酵解代谢。就表达而言,PD-L1似乎存在于细胞膜和细胞中。有趣的是,2019年发表在《分子细胞》杂志上的一项研究表明,细胞内的PD-L1还可以结合DNA损伤基因转录的RNA,增加肿瘤细胞对DNA损伤的耐受性[1]。科学家认为PD-L1似乎有新的未知的一面。此外,PD-L1亚细胞定位的调控机制尚不清楚。
先前的研究已经证实翻译后修饰可以调节蛋白质的亚细胞定位。虽然一些研究人员已经观察到PD-L1的乙酰化(一种翻译后修饰),但这种修饰对PD-L1的稳定性、功能和定位的影响仍不清楚。

8月24日,在《自然细胞生物学》发表的一项研究中,哈佛医学院的一组科学家报告了PD-L1的亚细胞调节机制和新的功能作用[2]。
具体来说,他们首先证明了PD-L1在其细胞质尾(C尾)被p300酶乙酰化,K263是PD-L1细胞质尾中唯一被p300乙酰化的残基。
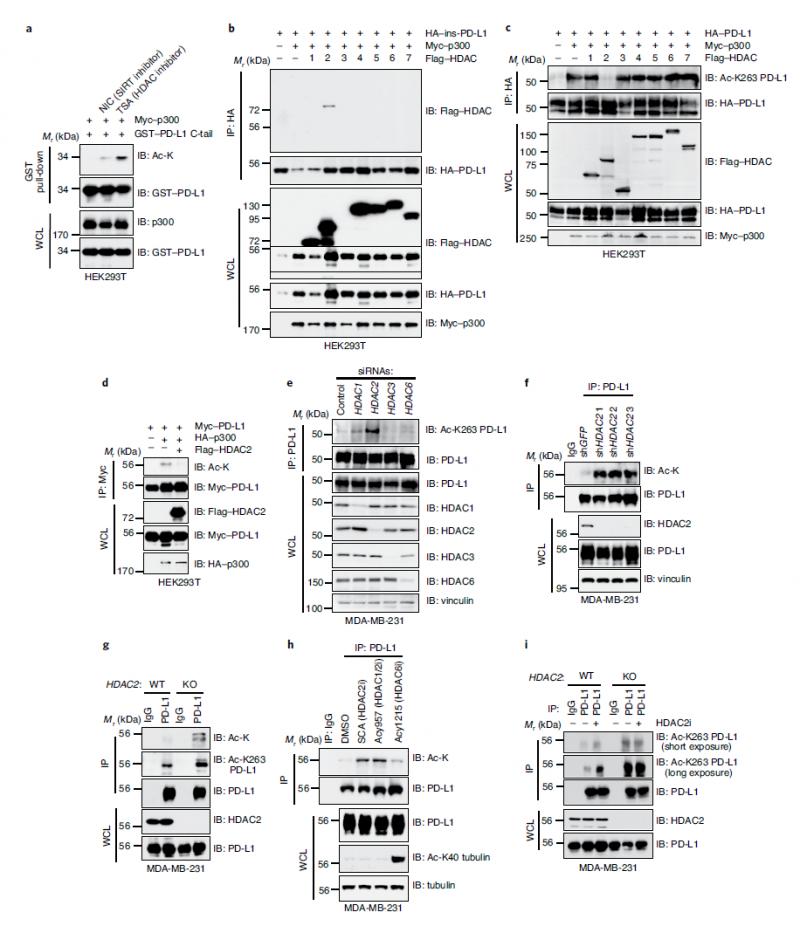
之后,研究人员调查了哪些酶可能介导PD-L1的去乙酰化,发现组蛋白去乙酰化酶2 (HDAC2)的药理学和遗传学缺失增强了PD-L1的乙酰化。
同时也证实了Lys 263的乙酰化可能会阻碍PD-L1的核定位。与各部分的乙酰化相比,核PD-L1的乙酰化程度相对较低。此外,HDAC2基因的缺失或药物抑制降低了核部分PD-L1的水平,这可能是由于PD-L1的Lys 263位点的乙酰化增加。这些发现表明PD-L1上Lys 263的乙酰化在核转位中起关键作用。一个有趣的发现是,与B16F10来源的皮下原发肿瘤(其中PD-L1主要表达在细胞膜上)相比,来自B16F10细胞的肺转移显示出更强的核PD-L1表达,这表明核PD-L1的积累可能有助于肿瘤细胞在转移过程中逃避免疫监视。
还发现HDAC2对膜结合PD-L1的脱乙酰化有利于其与包括HIP1R在内的许多蛋白质的相互作用。PD-L1通过其胞质尾与HIP1R特异性相互作用。Lys 263的乙酰化可能阻碍PD-L1与HIP1R的结合。用HDAC2抑制剂治疗也阻断了PD-L1和HIP1R之间的相互作用。此外,在HIP1R基因敲除细胞中,细胞核PD-L1显著减少,表明该蛋白可能在PD-L1的核转位中起重要作用。
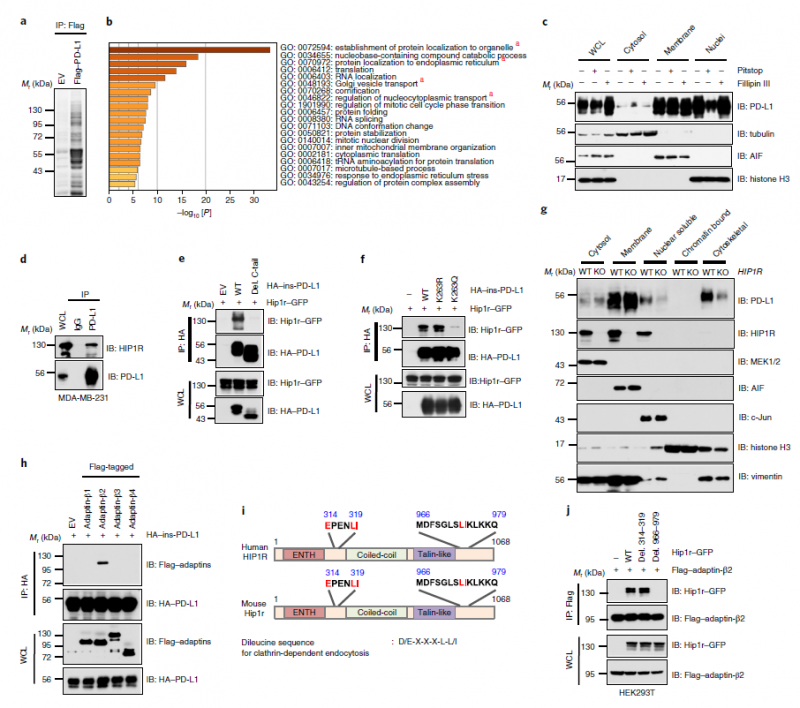
PD-L1与HIP1R相互作用,参与网状蛋白的内吞作用(来源:自然细胞生物学)
接下来,我们研究了PD-L1从质膜转移到细胞核的分子机制,发现HIP1R可以被衔接子in- 2 (AP2B1)识别,从而诱导网状蛋白介导的内吞作用。之后PD-L1与中间丝蛋白Vimentin(中间丝是细胞骨架的组成成分之一)结合,从而可以通过细胞骨架进入细胞核。波形蛋白缺失可降低PD-L1在细胞核中的表达。
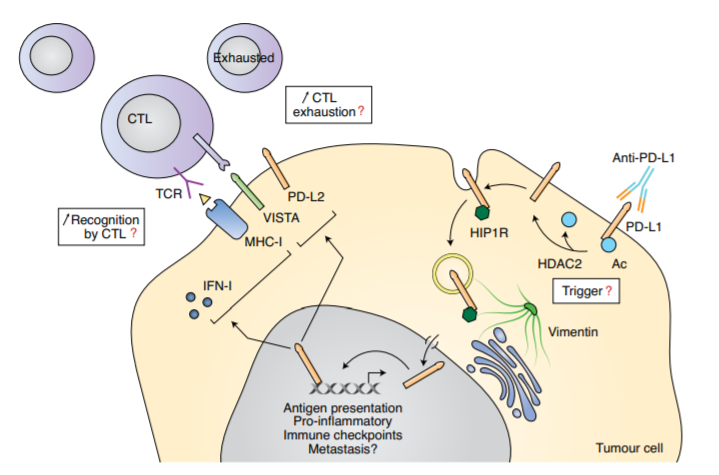
依赖脱乙酰化的PD-L1的核迁移支持肿瘤免疫逃逸|膜结合PD-L1通过HDAC2的脱乙酰化有利于其与包括HIP1R在内的各种蛋白质的相互作用,并允许PD-L1被内吞。PD-L1与波形蛋白结合,并通过细胞骨架转运至细胞核。然后由输入蛋白介导PD-L1的核转位,再由PD-L1与DNA相互作用控制基因转录。一方面,核PD-L1似乎可以调节抗原呈递相关基因(如MHC-I相关基因)和促炎通路(如IFN-I相关基因)的表达,从而提高细胞毒性T淋巴细胞(CTL)对肿瘤细胞的识别。另一方面,核PD-L1也增加了其他免疫检查点基因的表达,包括PD-L2和VISTA,这反过来增强了细胞毒性T淋巴细胞的耗竭,破坏了PD-L1阻断的治疗效果。尽管还需要进一步的研究,但核PD-L1活性似乎与肿瘤细胞的侵袭性有关。(来源:自然细胞生物学)
RNA测序和染色质免疫沉淀结合超高通量DNA测序分析表明,核PD-L1会与DNA结合,并作为基因转录的调节剂。进一步发现PD-L1的这种核活性可能促进肿瘤的免疫逃逸。因为核PD-L1会触发其他免疫检查点分子的表达,导致可能的获得性免疫治疗抵抗。而用HDAC2抑制剂阻断PD-L1的核转位,可能会减少这些免疫检查点基因的转录,导致肿瘤内CD8细胞毒性T细胞浸润增加,TNF水平降低,从而增强PD-1抗体触发的抗肿瘤免疫反应。在MC38同系小鼠肿瘤模型中,与PD-1抗体治疗组相比,HDAC2抑制剂联合PD-1抗体明显减缓了肿瘤生长,提高了生存率(下图e、f)。
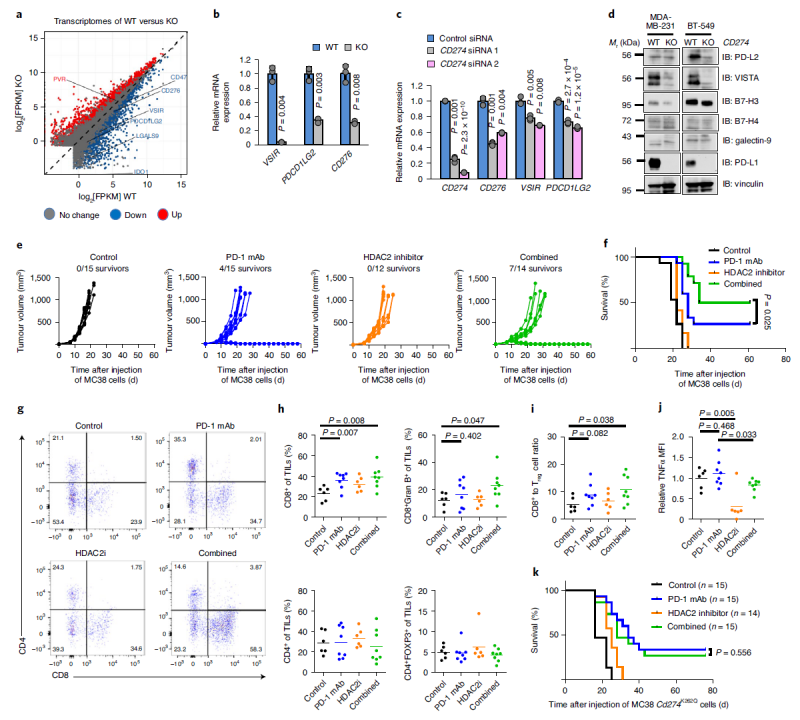
核PD-L1调节免疫反应和调节通路的基因表达,以影响抗PD-1免疫疗法的治疗效果(来源:自然细胞生物学)
值得一提的是,虽然这项新研究揭示了PD-L1以前未发现的功能和依赖乙酰化的核定位调控机制,但也提出了有趣的问题。例如,本研究报道了核PD-L1还可以上调肿瘤细胞中其他免疫检查点(包括PD-L2和VISTA)的基因,这有助于形成肿瘤细胞对PD1/PD-L1阻断治疗的获得性耐药性。但与此同时,核PD-L1似乎强烈诱导免疫反应相关基因,包括I型和II型干扰素信号通路、NF-kB信号通路和抗原提呈通路。这些发现提示,核PD-L1可能增加肿瘤微环境的炎症反应,促进新抗原的提呈,但也促进了抗肿瘤免疫的逃逸。是什么决定了PD-L1刺激一种途径而不是另一种途径仍有待阐明。一种可能的解释是,肿瘤细胞将自己暴露于细胞毒性T细胞并被识别,只是为了更好地将它们推向衰竭。
综上所述,这一新的研究进展揭示了此前未知的PD-L1依赖乙酰化的核定位调控机制,使人们对PD-L1途径有了更深入的了解。同时,文章表明PD-L1作为转录调节因子的有趣作用及其参与促炎通路和免疫检查点基因调节的新功能可能对使用检查点封闭疗法和HDAC抑制剂具有重要意义。未来,需要更多的研究来更好地了解调节核PD-L1活性的机制及其与肿瘤侵袭的关系。
参考资料:
[1]信义图等PD-L1 (B7-H1)与RNA外来体竞争调节DNA损伤反应,并可被靶向以对放射或化疗敏感。分子细胞(2019)。
[2]高阳等。PD-L1核转位的乙酰化依赖性调节决定了抗PD-1免疫疗法的疗效。《自然细胞生物学》(2020)。
[3]PD-L1隐藏的一面(来源:自然细胞生物学)
