摘要
abstract
申请仿制药的三个注射剂品种的一致性评价
恒瑞医药PD-1单克隆抗体注射用卡瑞珠单抗上市申请
又有两种CAR-T药物已经临床应用。
阿斯利康和美乐共同宣布了中国第一个授权的非专利瑞舒伐他汀钙片。
摩东的九价人乳头瘤病毒疫苗(酿酒酵母)获得有条件批准上市。
国家美国食品药品监督管理局公布第三批仿制药一致性评价目录,涉及7个品种。
总体承办情况
据MED中国药品审评数据库2.0统计,2018年4月,CDE共受理药品注册申请456件,同比下降。
图1:2017年11月至2018年4月CDE承担的药品注册申请(按受理号)

一致性评价申请承办情况
4月,19个一致性评价申请进入CDE,涉及15个品种,其中3个品种为注射剂,分别是海南金瑞药业的注射用盐酸吉西他滨、江苏德赛诺药业的盐酸拉贝洛尔注射液和四川于慧药业的注射用培美曲塞二钠。
目前苯磺酸氨氯地平片有1家企业通过了一致性评价,富马酸替诺福韦酯片有3家企业通过了一致性评价。
表1:2018年4月仿制药一致性评价受理情况
国内1类新药承办
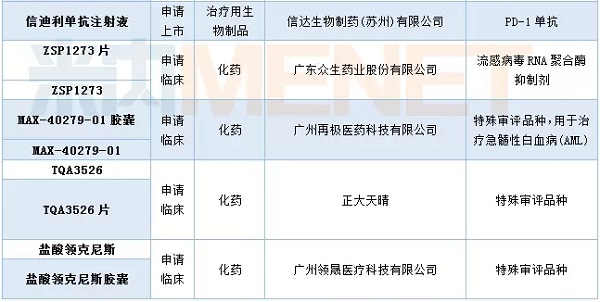
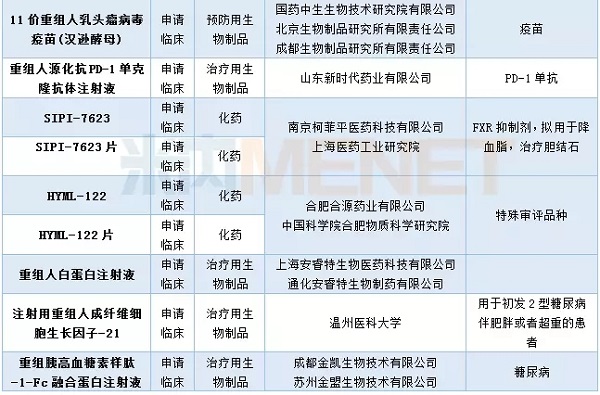
4月份,CDE共受理国内新药申请69件,其中第一类新药申请41件,涉及22个品种。信达再次提交PD-1单克隆抗体上市申请,恒瑞医药PD-1单克隆抗体(注射用卡列珠单抗)提交上市申请,成为国内第三家提交PD-1单克隆抗体上市申请的企业。上海科吉制药有限公司和思必曼生物有限公司的多种CAR-T药物进入CDE。有关其他信息,请参见下表。
表2:2018年4月我国一类新药承担情况
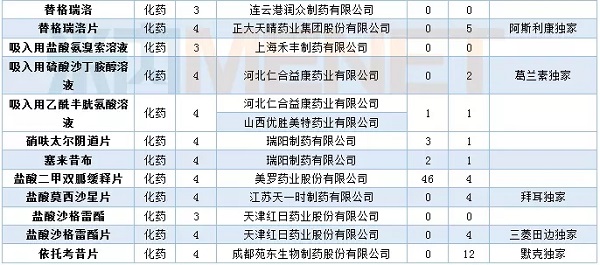
国内仿制药承办
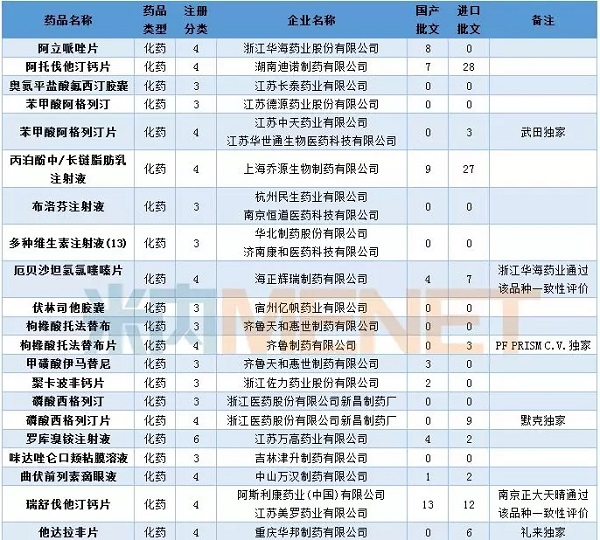
4月,CDE处理了53个仿制药申请,涉及33个品种,其中10个品种目前在中国独家经营。目前我国盐酸二甲双胍缓释片国内批文46个,进口批文4个,出现同质化迹象。此外,阿斯利康和江苏罗梅药业股份有限公司联合提出的瑞舒伐他汀钙片上市申请由CDE承担,这是首个在中国上市的授权仿制药。据了解,该品种的原料、包装材料和生产线与阿斯利康“丁可”原研药一致。
表3:2018年4月仿制申请承诺书

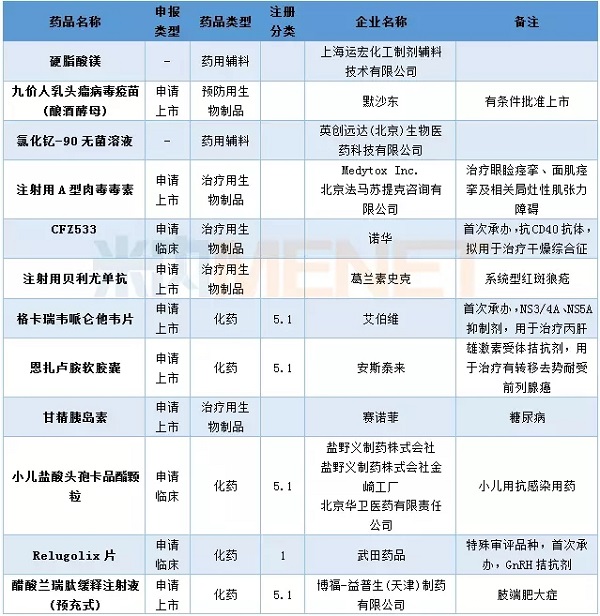
进口申请承办
4月,CDE处理了16项进口申请,涉及12个品种。诺华制药的CFZ533和艾伯维的格雷卡韦帕伦他韦片是首批签约品种。摩东的九价人乳头瘤病毒疫苗(酿酒酵母)在4月份提交了上市申请,目前已经获批并给予有条件批准上市。
表4:2018年4月CDE进口申请受理情况
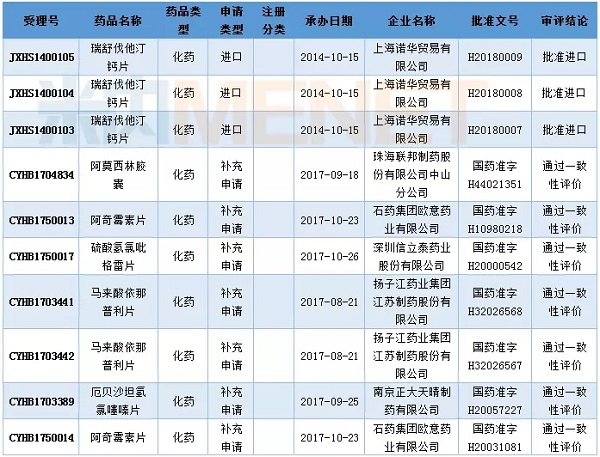
获批情况
4月,国家医药产品监督管理局发布了第三批通过仿制药质量和疗效一致性评价的品种名单。该批有7个品种规格通过了仿制药质量和疗效一致性评价。
表5:2018年4月部分申请获批