文|韩佳
随着监管政策法规的成熟,以及各利益相关方对生物类药物和改良创新型生物药物的逐渐接受,对生物类药物和改良创新型生物药物的产业状况有一个清晰而全面的了解,将有助于生物制药企业制定合理的投资和合作发展战略,从而促进其生物药物研发和参与区域或全球市场竞争。在明确生物相似药和改良创新生物药的定义后,从R&D进程、竞争格局、优势和劣势、主要国家或地区市场的风险和价值等角度,对生物相似药和改良创新生物药的产业状况进行比较分析,为相关机构制定和实施生物医药产业R&D发展战略、合作、投资和市场活动提供基于竞争情报的决策支持。
美国生物制药占上市药物市场份额的40%以上,同时占临床开发药物的37%左右[1]。随着一些上市多年的重组蛋白、单克隆抗体药物等重生物技术药物(生物药)专利的到期,生物仿制药迎来了发展的契机。目前,相关监管法律法规日趋成熟,医疗保险费用控制压力加大。与原研生物药相比,生物仿制药具有价格优势,可以节省医疗费用,扩大药品可及性,吸引了包括跨国药企在内的众多企业。未来生物类药物和化学仿制药一样,有望占据相当大的市场份额。与此同时,现有上市的生物药物一直在朝着长效、靶向、多功能(多靶点)、改善给药途径的方向升级产品。比如早在欧美药品监管部门给出生物制药的官方定义之前,重组促红细胞生成素Epogen等第一代重组蛋白药物就已经开始做长效改进,延长体内半衰期,比如糖基化Aranesp,作为创新型生物制药研发上市[2]。与原生生物药相比,创新生物药具有相同的作用机制和相似的活性分子功能结构。与原生生物药和同类生物药相比,创新生物药具有更好的安全性、有效性或患者依从性等临床优势。然而,与原生生物药一样,创新生物药可以作为新药注册上市[3],而且不像生物类似物那样有简化的许可程序,往往具有更高的研发成本或更高的市场价格。在国内外药品监管政策和标准越来越严格、医保管控力度越来越大、对上市药品安全性、有效性和经济性要求越来越高的环境趋势下,生物制药企业需要评估生物相似药和改良创新生物药各自的优缺点,平衡其风险和价值,制定合适的发展战略,完善生物制药R&D和投资的布局。本文从定义、R&D进展和竞争格局、优势和劣势等角度,对生物相似药和改良创新生物药进行了比较分析。为行业发展策略提供建议。
一、生物类似药与创新改良生物药的定义
自1982年第一个生物技术药物重组人胰岛素Humulin在美国获得FDA批准以来,已经过去了35年多。在此期间,各种生物药物不断涌现,除了具有全新靶点机制或新颖分子结构的原生生物药物,主要是后续生物制品,包括以下三类[4]:
1.仿制者:对原研究产品的仿制,但由于质量和成分的差异,一般认为是没有按照生物类似物的监管办法与原研究产品在质量、安全性和有效性方面进行严格比较,或未能验证两种产品具有高度的生物相似性,不能相互替代的仿制版本
2.生物相似药:根据主要国家和地区药品监管部门相关法律法规的一般要求,在质量、安全性、有效性等方面与已批准注册上市的原研药无临床差异且相似度高的一般为治疗性生物技术药物[5]。在美国,生物仿制药和原生生物药之间的临床无效成分可能存在细微差异,但它们之间在安全性、纯度和疗效方面不能存在“临床显著差异”[6]。生物相似药按新药申请简化许可程序上市,但不一定批准为与原研药临床可互换[7]。2017年初,FDA发布了生物类似物互换性的相关指南。生物类似物在满足相关要求后,可以被批准为原研究药物的可互换产品[8]。
3.改良创新型生物药:与某原研生物药具有相同的靶点机制,可视为对照药改良版的产品。这些药物没有被药监部门正式定义,作为行业对改良型和创新型生物制药的统称,强调的是对相应原研产品的改良。与原研生物药相比,改进和创新的生物药一般要求更好的安全性、有效性、经济性或患者依从性。因此也被称为“生物优势”[9],一般都有专利保护,并按照新生物制品的监管渠道申请上市审批[10]。另外,为避免混淆或歧义,除非另有说明,本文中的改良型和创新型生物药仅限于目前无法通过生物类似物监管渠道注册上市的。
二、研发进展对比分析
2.1生物相似药物和改良创新生物药物R&D项目总体分布比较。
生物制药行业在生物相似药物和改良创新生物药物研发方面的投资密切关注临床需求和商业机会。自第一代重组蛋白药物如Humira上市以来,改良型和创新型生物药物的研发就一直在进行,而生物类药物的商机则随着近10年各类原生专利生物药物的到期而出现。例如,仅在美国,预计到2021年将有超过70项生物制药专利到期[11]。在欧美,随着未来几年Humira等市值约1000亿美元的生物药失去关键专利保护,生物类药物研发的市场机会比以往任何时候都更大。同时,成熟市场与新兴市场在生物类药物和改良创新生物药物的研发方面存在较大差距,其中投资机会值得关注。
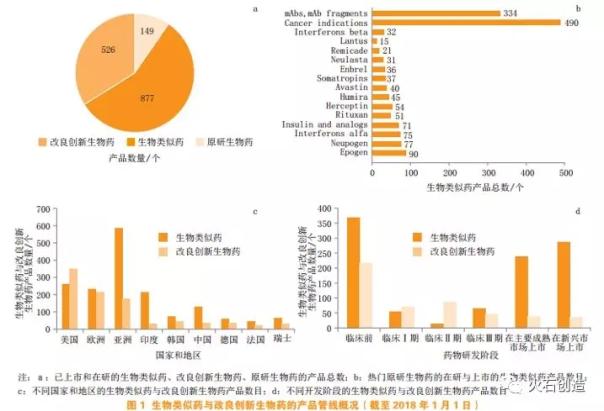
根据生物仿制药/生物仿制药管道目录统计,截至2018年1月1日[12],在主要市场上市的原研生物药共有149个。以这些原研生物药为参照产品,上市和在研的改良和创新生物药和生物仿制药数量分别为526个和877个(见图1a)。此外,877种生物仿制药中有一半以上(40。同类生物药中研发最热的原生生物药主要是重组蛋白类药物如重组人血红素启动子、单克隆抗体如阿达木单抗、融合蛋白如依那西普等重生物药。按照R&D企业总部所在国家和地区,分类计算已上市和未开发的生物相似药(含仿制产品)总数和改进创新生物医药产品总数[12-13](见图1c和图2a)。可以看出,从2017年1月到2018年1月,无论是发达国家还是成熟市场,二者的整体变化都较小;在美国,后者超过前者约100,而在欧盟,前者有所增加,从略少于前者到略多于前者;在德国、法国和瑞士这三个欧盟国家中,虽然这两类产品上市和在研的总数不多,但前者大约是后者的两倍,尤其是在法国。2017年大幅上涨后,前者从低于后者变为高于后者;在亚洲国家的新兴市场,对比同期上市和在研的生物相似药和改良创新生物药的总数,后者变化不大。前者约为后者的3倍,其中印度市场前者约为后者的10倍,中国市场前者约为后者的5倍,韩国市场前者约为后者的1.5倍。因此,美国在创新药物的全球研发中仍处于领先地位,中国、印度等新兴市场的生物药物研发仍以生物药物为主。它的改进和创新力度不如韩国,也远远落后于欧美发达国家。
比较不同产品开发阶段生物相似药和改良创新生物药的总数(见图1d和图2b),两者的变化直接反映了获批上市和R&D趋势。可以看到,从2017年1月18日到2018年1月1日,在新兴市场(中国、印度、俄罗斯、巴西、韩国、墨西哥、沙特阿拉伯、土耳其等)上市的生物相似药数量和改良创新生物药数量。)变化不大,而在主要成熟市场(欧盟、美国、日本),前者增长了4倍,后者略有增长,两者之间的差异从一点点变成了前者。对比同一时期不同研究阶段的其他生物相似药和改良创新生物药的数量可以知道,在临床前研究阶段,前者约为后者的1.75倍,前者略超过上市生物相似药的数量,而后者大大超过上市改良创新生物药的数量。在临床试验阶段,后者在临床试验I和II的开发阶段都超过了前者,尤其是临床试验II中后者与前者的比例从3倍增加到6倍。主要原因是前者略有减少,在研生物类似物产品减少的部分已推进到临床三期,使得临床三期的前者略有增加。然而,在临床试验III中,两者之间的总体差异并不显著。在全球范围内,相对于两种产品在临床试验中的总数,改良型和创新型生物药目前约占临床项目总数的2/3。可以预见,未来五年,即使改良型和创新型生物药的研发周期长于生物药,但仍将对整体生物药市场的快速增长趋势做出重要贡献,其在生物药增量市场中的比重不亚于生物药。随着相关监管政策的完善和部分原研药专利的到期,众多药企都在争夺热门的生物相似药市场,相关竞争无疑日趋激烈。一些在研的生物相似药物项目,临床前阶段占比较大,需要慎重选择是加速还是尽早放弃。预计未来五年,进入临床研发阶段并获批上市的生物相似药物项目数量也将呈现整体快速增加的趋势。同时,目前处于二期和三期临床试验的改良型和创新型生物制药产品将陆续获批上市,因此两类产品的增长潜力值得关注。
2.2欧美生物相似药物和改良创新生物药物批准情况比较
表1 FDA批准的仿生药物
表1 FDA批准的生物仿制药
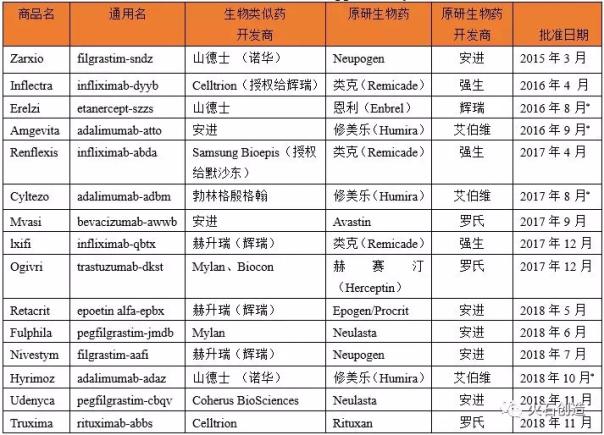
来源:FDA,截至2018年11月30日;*:已获美国FDA批准,但处于等待专利到期阶段,尚未上市销售。
表2欧盟药品管理局批准上市的生物相似药物
表2 EMA批准的生物仿制药
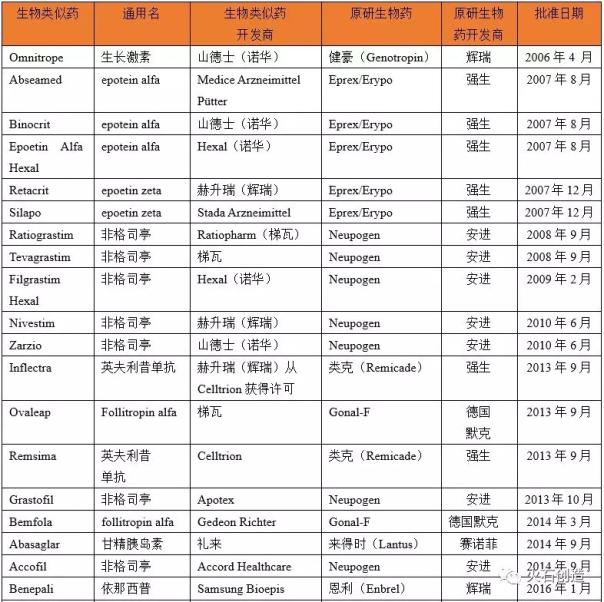
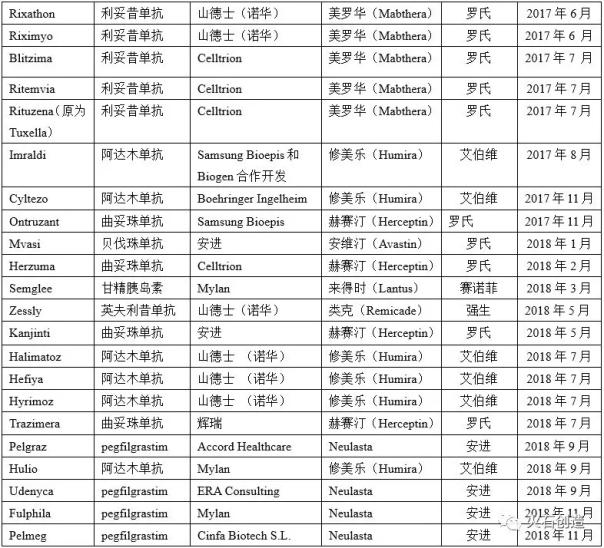
根据美国FDA和EMA批准上市的生物类似物统计(见表1和表2),欧盟作为全球最早建立健全生物类似物监管体系的成熟市场,于2006年批准了第一个生物类似物(Omnitrope),截至2018年11月30日,共有52个生物类似物获准上市(不包括已撤回的产品)。从2006年到2012年,第一代重组蛋白药物是EMA批准上市的生物类似物。2013年,EMA批准英夫利昔单抗生物类似物Remsima上市,成为全球首个单克隆抗体生物类似物。2013年至2018年,EMA批准欧盟上市的生物类似物类别转向单克隆抗体、融合蛋白和胰岛素类似物等复杂生物药物。在此期间,欧盟上市的生物类似物数量为41个,其中单克隆抗体数量约占一半,包括英夫利昔单抗(4个)、阿达木单抗(8个)和利妥昔单抗(。与欧盟相比,美国作为全球最大的处方药和生物药单一市场,在生物药的监管和监管指导体系建设上相对落后。直到2015年3月,FDA才正式批准Sandoz(诺华)研发的首个生物制药产品Zarxio(filgrastim-sndz)在美国上市。但近年来,美国FDA批准的生物类似物上市进程不断加快。FDA不仅比EMA更早批准阿达木单抗两个生物类似物上市,还在2017年率先批准贝伐单抗和曲妥单抗上市。目前FDA批准的生物类似物有15个。但由于艾伯维的Humira(阿达木单抗)和安进的Enbrel在美国的专利尚未到期,安进的Amjevita、山德士的Erelzi和Hyrimoz、勃林格殷格翰的Cyltezo四种生物类似物目前无法进入美国市场。此外,值得注意的是,由于FDA药品监管法规的历史原因,一些激素重组蛋白药物此前是通过新药申请(NDA)注册上市的。目前,还有另外两种产品可以被视为生物类似物,分别是山德士的Omnitrope(生长激素)和礼来的Basaglar(甘精胰岛素),通过505(b)(2)途径被批准进入美国市场[11]。
表3欧盟EMA和美国FDA批准上市的改进和创新生物药物的典型案例
表3 EMA和FDA批准的部分代表性生物制剂
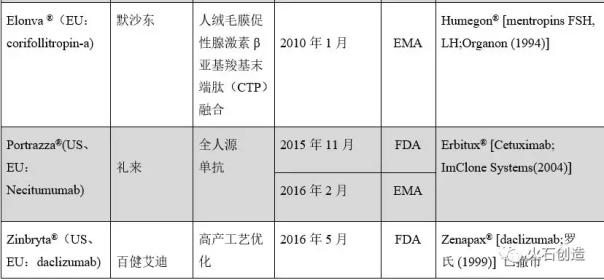
与最近10年逐渐出现和标准化的生物类似物不同,改进和创新的生物药物的研究和开发从第一代重组蛋白药物如重组人胰岛素的改进开始。目前,在欧美等发达国家成熟市场,重组蛋白药物普遍进入长效改良创新生物药时代,部分产品如胰岛素类似物也有速效改良创新生物药上市,呈现改良创新生物药与原研生物药及其生物类似物并存的现状,改良创新生物药逐渐取代第一代产品的趋势[9]。目前,从早年基于聚乙二醇化和糖基化转化的化学修饰技术,到Fc融合、HSA融合、CTP融合等不同特性融合蛋白的长效技术,多种长效技术平台已相继开发并成功应用于新一代重组蛋白药物的研发[2];单抗从早期的鼠单克隆抗体、人鼠嵌合单克隆抗体逐渐发展到主流的人源化单克隆抗体和全人源单克隆抗体。此外,表达菌株的改良、生产工艺的优化、亲和力的成熟等抗体工程技术的发展,充分促成了改良型、创新型单克隆抗体的研发。同时,靶向性、多功能的改良创新型生物制药产品如将靶向蛋白结构域与毒素蛋白融合表达的多功能融合蛋白药物、单克隆抗体大分子与细胞毒性小分子定点偶联制备的抗体偶联物等获得批准。根据欧盟EMA和美国FDA批准上市的一些具有代表性的改良创新生物药(见表3) [2,14],近年来,虽然改良创新生物药批准上市的产品数量不如同类生物药,但改良创新生物药通过使用上述各种改良技术方法,可以提供以临床优势为核心的差异化产品,并将在后续竞争日益激烈的生物药领域逐渐显示出市场竞争力。
下篇 内容预告:
三。竞争格局的比较分析
四。风险价值的比较分析
动词(verb的缩写)总结和建议
本文改编自2018年6月《药学进展》的同名文章。原文是在通讯员郑晓楠老师的指导下写的,特别感谢《药学进展》授权改编发布。
[参考文献]
[1] Mike全球仿制药、生物仿制药和原料药制造商展望:趋势、机遇与挑战[R].费城:Clarivate Analytics生命科学,2017年。
[2] Strohl W R .融合蛋白用于生物制剂的半衰期延长作为制造生物制剂的策略[J].生物药物,2015,29(4): 215-239。
[3] Sandeep V,Parveen J,Chauhan P. Biobetters:更好的生物制剂及其监管概述[J].Int J Drug Regul A,2016,4(1): 13-20。
[4]易遥。Biobetter或万盛生物仿制药[N]。医学经济学杂志,2012-02-27(002)。
[5]范,郑烈娥,等.国内外生物相似药物注册管理概况及启示[J].中国药事,2016,30(4): 309-320。
[6] Dalle R J .生物仿制药:对美国和欧盟法规的考虑[J].Regul Toxicol Pharmacol,2016,76(2):199-208。
[7]:问答[EB/OL]。(2015-10-15)[2018-01-15].下载/药物/指导
合规监管信息/指南/
食品药品管理局。证明与参考产品可互换性的考虑因素[EB/OL]。(2017-01-12) [2018-01-15].
[8]美国食品和药物管理局。证明与参考产品可互换性的考虑因素[EB/OL]。(2017-01-12) [2018-01-15].
[9]Alexandra B . S,Radhika N,Paul H .第9章-biobet生物制剂[M]//ManMohan S,Maya S .生物制剂、疫苗和癌症治疗的新方法和新策略。伦敦:学术出版社,爱思唯尔公司,
2015: 199-217.
[10] Ernst R B,Mark R T,《美国和欧洲的生物相似和生物更好的情况:我们应该期待什么?[M]//Amy R,Barthlemy:接近治愈的蛋白质工程。纽约:斯普林格,2015: 315-360。
[11]马里谢列布罗夫。生物仿制药:欧盟和俄罗斯的机遇与挑战
13生物技术信息研究所。生物仿制药/生物改善剂管道目录[EB/OL].(2017-01-18) [2017-10-28].
[14] Beck A. Biosimilar,biobetter和下一代治疗性抗体[J]。人与生物圈计划,2011,3(2): 107-110。