文|辛玲
2020年将是制药业“多事之秋”。世界各地的许多制药公司正在以疯狂的速度开发新冠肺炎治疗药物或疫苗。到目前为止,新冠肺炎已经在全球范围内夺去了194万人的生命。
随着各国的封锁,多国药品监管机构暂停了现场检查。原本预计2020年年中新药获批率会低很多。然而,在研究了食品药品监督管理局(FDA)和欧洲药品管理局(EMA)去年7月批准的新药后,发现截至6月底,美国FDA已批准了33种新药。这一数字处于过去两年的平均范围内,这让制药公司对新冠肺炎疫情的影响抱有希望。
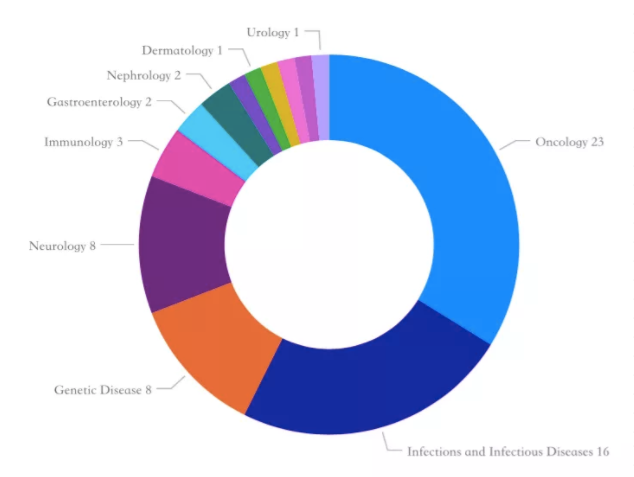
截至12月31日,美国FDA已批准58种新药,药物评价与研究中心批准53种化学制剂,生物制剂评价与研究中心批准5种生物制剂。这一数字甚至高于2019年批准的新药数量(54个)。其中,礼来和吉利德各有4个新药适应症获批,并列第一。从治疗领域来看,肿瘤领域获批23个,感染性疾病和感染16个,遗传性疾病8个,神经内科8个,免疫学3个,胃肠疾病2个。
EMA这一年也很忙,他们出具了75份正面批准意见。在这75个新药批准适应症中,诺华获得了8个,处于领先地位;辉瑞和赛诺菲紧随其后,各有4家。
按治疗领域划分,肿瘤领域21个,感染性疾病和感染19个,遗传性疾病6个,免疫学5个,肺/呼吸系统疾病5个,心脏/血管疾病4个,内分泌疾病4个,神经系统疾病4个。
以EUA为标志的一年
随着新冠肺炎疫情肆虐全球,药品紧急使用授权占据了新闻头条。2020年,FDA发布了10份EUAs,其中最具代表性的授权药物是辉瑞/BioNTech和Moderna公司的新冠肺炎疫苗。
EUAs中也有有争议的产品。例如,今年3月,美国FDA发布了口服磷酸氯喹和硫酸羟氯喹治疗新冠肺炎的EUA。然而,到6月份,这种EUA被撤回,因为FDA认定氯喹和羟氯喹不太可能对治疗新冠肺炎有效。
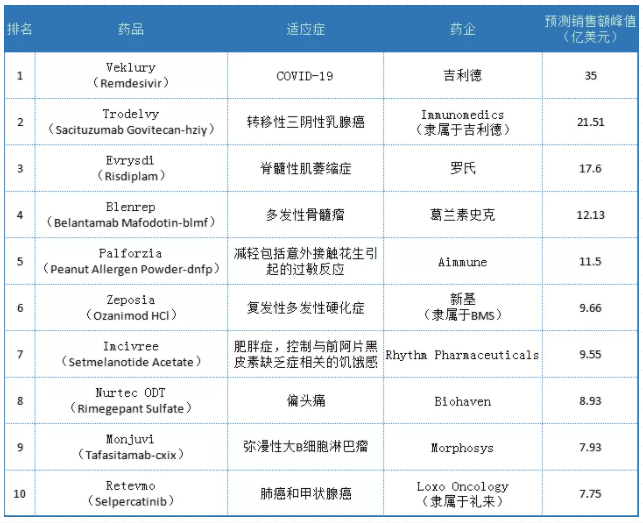
与此同时,EUAs也生产重型药物。5月,FDA批准紧急使用吉利德抗病毒药物remdesivir。在随后的几个月里,Remdesivir迅速攀升至2020年最畅销药物的榜首。去年10月,这种药物成为美国FDA批准的第一种用于需要住院治疗的新冠肺炎患者的药物。尽管这种药物在新冠肺炎住院患者中的治疗前景仍不确定,特别是在世界卫生组织(世卫组织)牵头的试验中显示,雷地昔韦对新冠肺炎患者的28天死亡率或住院时间几乎没有影响,但分析师仍预计雷地昔韦将实现35亿美元的销售峰值。
2020年FDA批准的十大药物销售预测
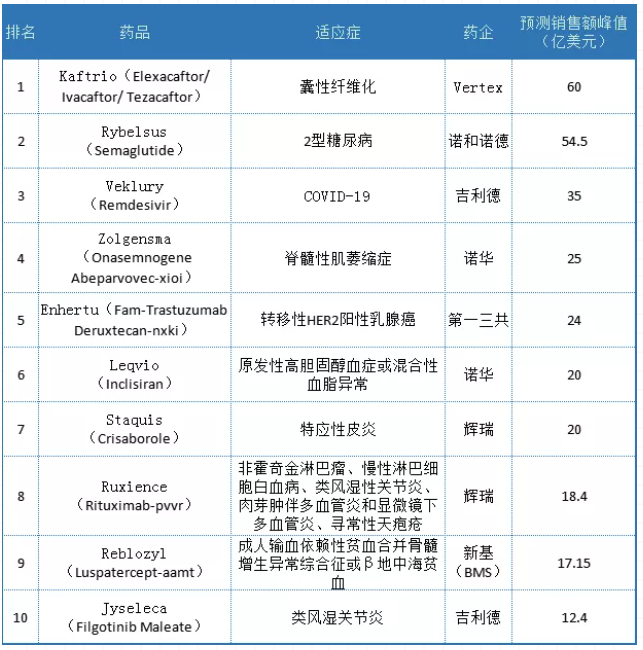
2020年,欧洲药品管理局(EMA)批准了药品。
十大销售预测
吉利德以210亿美元收购Immunomedics
除了Remdesivir的成功,2020年全球医药行业还有很多值得总结的事件,包括吉利德。4月,免疫医学家的抗体-药物缀合物(ADC)Trodelvy(sacituzumab-govitecan-hziy)获得FDA批准,用于之前接受过至少两种治疗的转移性三阴性乳腺癌成年患者。这些肿瘤占乳腺癌患者的15%-20%。因此,Trodelvy紧随Remdesivir之后,入选了2020年FDA批准的最具销售潜力的重磅炸弹药物名单。目前预测到2026年Trodelvy的销售额将达到21.51亿美元。
然而,仅仅5个月后,2020年9月,Gilead决定迈出重要一步,以210亿美元收购生物技术公司Immunomedics。这笔交易于10月份完成,加强了Gilead的癌症组合,并为其增加了另一种潜在的重磅药物。
Immunomedics正计划提交补充生物制剂许可证申请(BLA),以支持Trodelvy在今年第一季度在美国获得完全批准。此外,Immunomedics预计将于2021年上半年在欧洲申请Trodelvy的监管批准。同时,正在进行的研究也在评估这种药物在治疗非小细胞肺癌和ot方面的潜力
在FDA批准潜在新药Troveldy上市销售后,罗氏和PTC公司的Evrysdi(risdiplam)被批准为治疗脊髓性肌萎缩症(SMA)的首个口服药物。直到四年前,这种罕见的遗传疾病还没有有效的治疗方法。2016年,由薄健和Ionis研发的药物Spinraza(nusinersen)获批,成为全球首个治疗SMA的药物。这种基于RNA的药物通过鞘内注射给药,每年需要输注三次到医生办公室。2019年5月,诺华基因疗法zolgensma(onasemnogene abeparvovec)获批,成为全球首个sma基因疗法。该药物通过单次和一次性静脉输注给药。
Evrysdi的获批为患者和家属提供了另一种独特的选择:他们可以每天在家口服药物。罗氏根据患者体重定价,最高年费用34万美元,远低于博健和诺华的上市竞争产品。
罗氏和PTC Therapeutics研发的risdiplam批准
Vertex的囊性纤维化药物Trikafta是ivacaftor、tezacaftor和elexacaftor的组合。其出色的临床数据使FDA在Vertex提交上市申请后的三个月内和FDA采取行动前的五个月内批准了该药物。
Trikafta在2019年美国FDA批准的新药销售预测中排名第一,预计到2024年销售额将达到39.35亿美元。2020年6月,EMA人类医学委员会(CHMP)采纳了积极的意见,建议给予Vertex复方药物的上市授权,以Kaftrio的商品名上市。打开欧洲市场后,该药将进一步创造销售高峰。
Vertex的Kaftrio获得EMA批准
2020年并不是一切都会顺利。事实上,这一年有很多波折,——44种药物没有获得FDA的批准。百时美施贵宝(BMS)是遭遇挫折的公司之一。作为740亿美元收购Celgene的一部分,BMS向Celgene的股东提供了CVR股票。根据协议,CVR将使新集的股东获得每股9美元的一次性预定收益,但前提是必须在规定期限内完成三个原新集药品的审批。
去年3月,FDA批准了由BMS和蓝鸟生物公司生产的鞘氨醇1-磷酸受体激动剂ozanimod用于治疗复发性多发性硬化症,大大提前于2020年12月31日的最后期限。然而,其余两种药物的审批仍无进展。
5月,两家公司宣布收到美国FDA对其CAR-T疗法的生物制剂(BLA)申请的拒绝函,idecabtagene vicleucel (ide-cel)用于未治疗、严重、复发和难治性多发性骨髓瘤患者。初步审查后,FDA认为ide-cel的化学、制造和控制(CMC)模块需要提供进一步的细节以完成审查。2021年3月31日前给予批准决定。
随后,BMS宣布美国FDA将另一种CD19导向的CAR-T疗法Lisocabtagene Maraleucel(Liso-cel)的BLA有效期延长3个月,至2020年11月16日。Liso-cel用于患有复发性或难治性大B细胞淋巴瘤的成年患者,这些患者之前至少接受过两次治疗。然而,11月16日,FDA继续通知liso-cel,BLA审查无法完成。到目前为止,还没有消息。
此外,美国FDA也拒绝批准诺华的降脂药物inclisiran。2019年,诺华以97亿美元收购了这家药品公司,因为诺华对后者拥有的inclisiran感兴趣。这种药物已经被欧洲委员会批准销售。
诺华公司表示,FDA没有提出任何关于英利西兰疗效或安全性的担忧。拒绝的原因是与检查制药设施有关的未决条件。而FDA没有进行现场检查。
新疗法审批的多次挫折
像制药公司一样,全球药品监管机构正在以疯狂的速度加快药物审批和EUAs,特别是针对新冠肺炎的治疗和疫苗。
除了新冠肺炎,细胞和基因治疗在这一年得到了更广泛的采用和批准,一些创新药物也获得了批准,如relugolix(首个用于治疗晚期前列腺癌成年患者的口服促性腺激素释放激素受体拮抗剂)和berotralstat(首个每日口服一次的血浆激肽释放酶抑制剂,用于预防12岁及以上成人和儿童遗传性血管性水肿的发作),lumasiran(HAO1的靶向小干扰RNA 其用于治疗儿童和成人的原发性1型高草酸尿症并降低尿草酸水平)和osilodrostat(用于治疗成人的库欣病)。
此外,一些有趣的“非Covid”医学突破发生在2020年。其中一项突破是开发了一种单一的片剂,它结合了四种降低血压和胆固醇的药物,以及降低心脏病风险的阿司匹林。
虽然制药公司和监管机构表现出的敏捷行动令人印象深刻,但许多国家已经授予EUA新冠肺炎疫苗。然而,持续的疫情确实让人类陷入了几个月的困境。新型冠状病毒危机不会是最后一个疫情。如果气候变化和动物问题得不到解决,改善人类健康的努力将注定失败。因此,从这次疫情事件中,医药行业可能还有很多需要学习和总结的地方。
参考资料:
1.FDA和EMA批准的新药:2020年回顾
2.AveXis获得欧盟委员会批准,并启动Zolgensma的“第一天”准入计划,这是脊髓性肌萎缩症(sma)的唯一基因疗法
3.由于FDA再次推迟liso-cel的申请,百时美施贵宝9美元的Celgene CVR公司正处于灾难的边缘
4.CVR与BMS的Celgene收购案有关,FDA再次推迟对liso-cel的审查